Proliferationsförderung und Biokompatibilität von Polihexanid
Cornelia Wiegand 1Martin Abel 2
Axel Kramer 3
Gerald Müller 3
Peter Ruth 2
Uta-Christina Hipler 1
1 Klinik für Dermatologie und dermatologische Allergologie, Universitätsklinikum, Jena, Deutschland
2 Lohmann & Rauscher GmbH & Co. KG, Rengsdorf, Deutschland
3 Institut für Hygiene und Umweltmedizin der Ernst-Moritz-Arndt-Universität, Greifswald, Deutschland
Zusammenfassung
Die Therapie von kritisch kolonisierten oder lokal infizierten chronischen Wunden verlangt oft eine antiseptische Behandlung, um pathogene Mikroorganismen, die zu einer Infektion führen könnten, abzutöten. Dabei wird in zunehmendem Maß die Kombination von Wundverbänden mit antimikrobiellen Mitteln wie Silber, PVP-Iod oder Polihexanid verwendet. Polihexanid ist wegen seiner guten guten Haut- und Wundverträglichkeit in Verbindung mit der antimikrobiellen Effektivität das Mittel der Wahl zur Behandlung dieser Wunden. Darüber hinaus besitzt es auch das Vermögen, sowohl in vitro als auch im Tiermodell die Wundheilung durch eine verbesserte Proliferation der Hautzellen zu fördern.
In der vorliegenden Studie konnte anhand von zwei verschiedenen Methoden gezeigt werden, dass Polihexanid in geringen Konzentrationen (bis zu 2 µg/ml) einen positiven Effekt auf die Proliferation humaner Keratinozyten hat. Konzentrationen von Polihexanid >2 µg/ml, inhibierten in den Versuchen entweder die Zellproliferation oder waren direkt zytotoxisch für die getesteten Zelltypen in vitro.
Schlüsselwörter
Polihexanid, Keratinozyten, Infektion, chronische Wunde
Einleitung
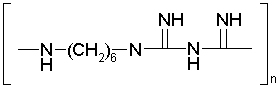
Bei der Therapie kritisch kolonisierter oder lokal infizierter chronischer Wunden ist oft zusätzlich eine antiseptische Therapie notwendig, um pathogene Mikroorganismen, die zu einer Infektion führen können, abzutöten. Dabei wird in zunehmendem Maß die Kombination von Wundverbänden mit antimikrobiellen Mitteln wie Silber, PVP-Iod oder Polihexanid verwendet. PVP-Iod und Octenidin werden vor allem für die Reinigung akuter Wunden genutzt, während Polihexanid wegen der geringen Zytotoxizität und guten Hautverträglichkeit neben der antimikrobiellen Effektivität Mittel der Wahl für die Behandlung kritisch kolonisierter oder lokal infizierter chronischer Wunden ist. Polihexanid besitzt als aktive kationische Substanz (Abbildung 1 [Abb. 1]) einen spezifischen Wirkmechanismus gegenüber sauren Lipiden bakterieller Membranen und beeinflusst die neutralen Lipide humaner Zellmembranen nur geringfügig [1]. Darüber hinaus besitzt es eine anti-inflammatorische Wirkung [unveröffentlichte Daten], und es wurde ein positiver Effekt auf den Wundverschluss in vivo beobachtet [2]. Ziel der vorliegenden Studie war es, den Einfluss von Polihexanid auf die Proliferation drei verschiedener Zelllinien (NHDF, NHEK und HaCaT-Zellen) zu untersuchen.
Abbildung 1: Struktur von Polihexanid
Material und Methoden
Viabilität und Proliferation von humanen Fibroblasten, Keratinozyten und HaCaT-Zellen wurde mittels mikroskopischer Evaluierung von lebenden und toten Zellen (analySIS® 3.1 Soft Imaging System GmbH, Germany) untersucht bzw. über die Bestimmung des ATP-Gehalts mit dem ATPLite™-M kit (Perkin Elmer) ermittelt. Dazu wurden die Zellen in 8-Well-Objektträger bzw. 96-Well-Mikrotiterplatten eingesät und für die Zeit von 48 h mit steigenden Polihexanid-Konzentrationen (0,2-40 µg/ml) inkubiert. Um zwischen lebenden und toten Zellen unterscheiden zu können, wurden die Zellen mit SYTO-13 und Ethidiumhomodimer-2 (Molecular Probes) gefärbt. Der luminometrische ATP-Assay basiert auf der Detektion von Licht, das in der ATP-abhängigen Umsetzung von D-Luziferin durch das Enzym Luziferase entsteht. Die Menge an freigesetztem IL-6 und IL-8 wurde mit Hilfe von spezifischen ELISAs (humanes IL-6 bzw. IL-8 ELISA, Milenia biotec) gemessen.
Ergebnisse
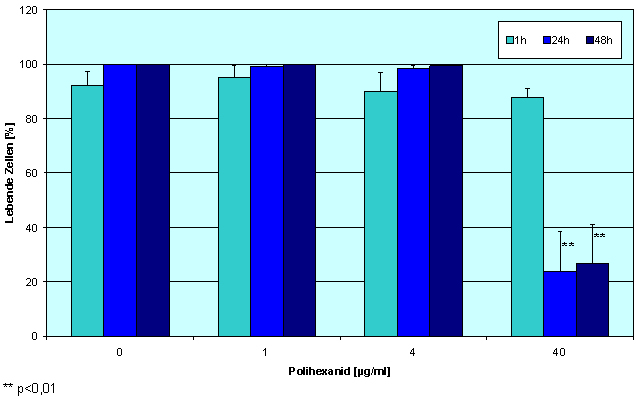
Polihexanid hat in niedrigen Konzentrationen eine positive Wirkung auf humane Zellen. Wir konnten zeigen, dass Konzentrationen von 0,2-2 µg Polihexanid/ml einen proliferativen Effekt auf Keratinozyten haben; im Vergleich zur Kontrolle wurden bis zu 20% mehr lebende Zellen gefunden (Abbildung 2 [Abb. 2], repräsentative Ergebnisse für NHEK). Für HaCaT-Zellen wurden ähnliche Ergebnisse erhalten. Humane Fibroblasten tolerierten diese Polihexanid-Konzentrationen, zeigten in der Inkubationszeit aber keine signifikante Steigerung der Proliferation. Höhere Polihexanidkonzentrationen (>2 µg/ml) wiesen dagegen einen negativen Effekt auf das Wachstum aller Zelltypen auf. Diese Beobachtungen wurden durch die mikroskopische Evaluierung der mit Zellen bedeckten Fläche nach Färbung mit SYTO-13 und EthD-2 bestätigt (Abbildung 3 [Abb. 3]). Die Lebend-/Tot-Färbung ließ eine signifikante Zunahme der abgestorbenen Zellen bei 40 µg/ml Polihexanid erkennen. Überraschenderweise zeigte dagegen die mittlere Konzentration von 4 µg/ml fast 100% lebende Zellen und nur eine signifikant niedrigere Anzahl an Zellen im Vergleich zur Kontrolle (Abbildung 4 [Abb. 4] und Abbildung 5 [Abb. 5]).
Abbildung 2: Einfluss von Polihexanid auf die Proliferation von Keratinozyten (NHEK), ermittelt durch die Messung des ATP-Gehaltes (Mittelwert±SE)
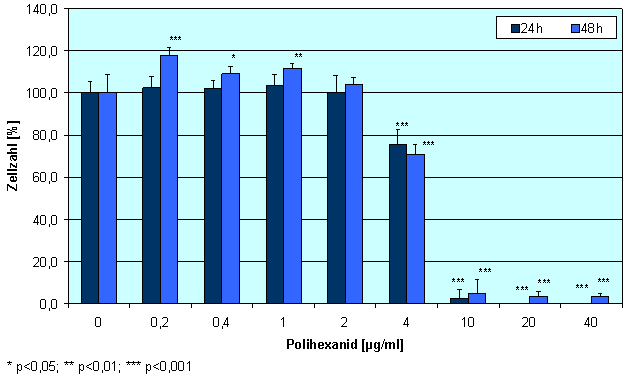
Abbildung 3: Färbung von HaCaT Zellen mit SYTO-13 und Ethidiumhomodimer-2 nach Inkubation mit Polihexanid für bis zu 48 h. Lebende Zellen sind grün gefärbt, abgestorbene rot (100fache Vergrößerung).
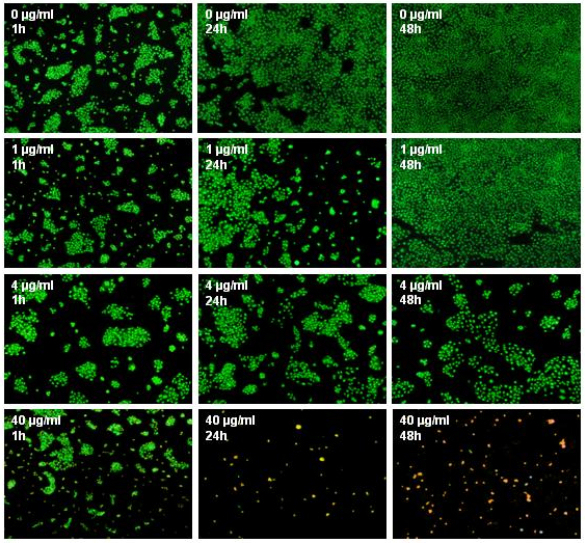
Abbildung 4: Färbung von HaCaT Zellen mit SYTO-13 und Ethidiumhomodimer-2 nach Inkubation mit Polihexanid für bis zu 48 h. Lebende Zellen sind grün gefärbt, abgestorbene rot (400fache Vergrößerung).
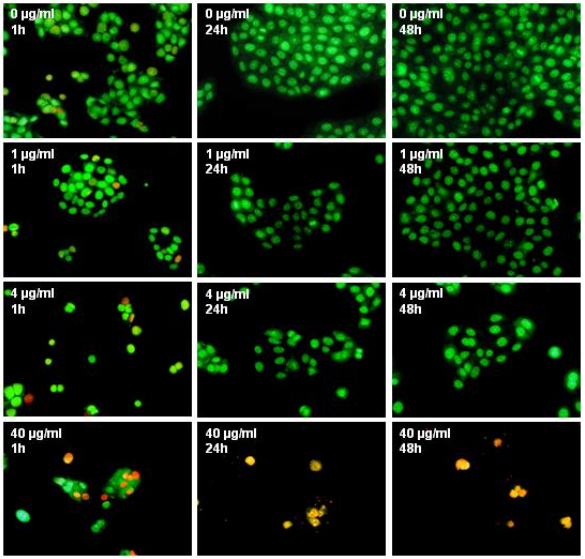
Abbildung 5: Einfluss von Polihexanid auf die Viabilität von HaCaT Zellen. Lebende Zellen in Prozent im Vergleich zu der Gesamtzellzahl nach mikroskopischer Evaluierung der Bilder aus Abbildung 3 (Mittelwert ± SE)
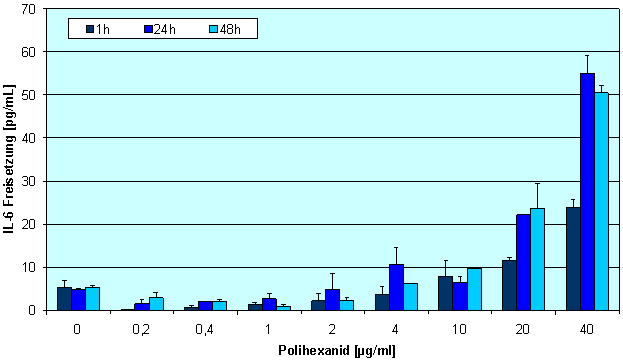
Darüber hinaus haben wir die Interleukinproduktion von HaCaT-Zellen unter dem Einfluss von Polihexanid untersucht (Abbildung 6 [Abb. 6]). Proliferations fördernde Konzentrationen (0,2-2 µg/ml) senkten die Produktion von IL-6 im Vergleich zur Kontrolle während der Inkubationszeit (Abbildung 6 [Abb. 6]), während Konzentrationen von Polihexanid >2 µg/ml die IL-6-Produktion zeit- und konzentrationsabhängig erhöhten. Für IL-8 wurden vergleichbare Ergebnisse gefunden.
Abbildung 6: IL-6 Produktion von HaCaT Zellen unter dem Einfluss verschiedener Polihexanidkonzentrationen (Mittelwert ± SE)
Diskussion
Polihexanid ist ein hoch wirksames Antiseptikum, das in mikrobioziden Konzentrationen nicht nur besser verträglich ist als andere antimikrobielle Verbindungen wie Chlorhexidin, Octenidin und PVP-Iod, sondern auch das Vermögen besitzt, sowohl in vitro als auch im Tiermodell Proliferation zu induzieren [2]. Darüber hinaus konnte ein positiver Effekt von Polihexanid auf die Wundheilung bei klinischen Verbrennungen 2. Grades gezeigt werden [3]. In den in vitro Untersuchungen wurde ein proliferativer Einfluss von Polihexanid auf Keratinozyten in Konzentrationen bis zu 2 µg/ml gefunden. In diesen Konzentrationen wird die Vitalität nicht beeinflusst und die Freisetzung von inflammatorischen Zytokinen ist im Vergleich zur Kontrolle geringfügig erniedrigt. Konzentrationen von Polihexanid >2 µg/ml inhibieren entweder die Zellproliferation oder sind direkt zytotoxisch für die getesteten Zelltypen in vitro. Dieser Effekt wird von einer zeit- und konzentrationsabhängigen Erhöhung der IL-6- und IL-8-Freisetzung begleitet. In Wundauflagen wie Suprasorb® X+PHMB wird Polihexanid (syn. PHMB) für gewöhnlich in Konzentrationen von 0,2-0,3% verwendet. Dennoch wurden klinisch keine der für die höheren Konzentrationen auf den Zellen beschrieben zytotoxischen Effekte beobachtet und sie traten ebenfalls nicht im in vitro Zytotoxizitätstest nach der ISO-Norm 10993-5 mit Suprasorb® X+PHMB auf. Aufgrund der protein- und membranbindenden Eigenschaften von Polihexanid ist also zu erwarten, dass eine erheblich geringere Menge an freigesetztem Agens die antimikrobielle Wirkung ebenso wie die zusätzlichen proliferativen und antiinflammatorischen Effekte in exsudierenden kritisch kolonisierten oder infizierten Wunden erzielt. Dies wird durch die bisherigen in vitro Versuche und die klinische Erfahrung bestätigt.
Literatur
[1] Ikeda T, Tazuke S, Watanabe M. Interaction of biologically active molecules with phospholipid membranes. I. Fluorescence depolarization studies on the effect of polymeric biocide bearing biguanide groups in the main chain. Biochem Biophys Acta. 1983;735(3):380-6.[2] Kramer A, Roth B, Müller G, et al. Influence of the antiseptic agents polyhexanide and octenidine on FL cells and on healing of experimental superficial aseptic wounds in piglets. A double-blind, randomised, stratified, controlled, parallel-group study. Skin Pharmacol Physiol. 2004;17(3):141-6.
[3] Daeschlein G, Assadian O, Bruck JC, et al. Feasibility and clinical applicability of polihexanide for treatment of second-degree burn wounds. Skin Pharmacol Physiol. 2007;20:292-6.




