In-vitro-Evaluierung von Polihexanid: biokompatibel und effektiv
Cornelia Wiegand 1Martin Abel 2
Peter Ruth 2
Uta-Christina Hipler 1
1 Klinik für Dermatologie und dermatologische Allergologie, Universitätsklinikum Jena, Deutschland
2 Lohmann & Rauscher GmbH & Co. KG, Rengsdorf, Deutschland
Zusammenfassung
Infektionen sind eine häufige Ursache für die Entstehung und Aufrechterhaltung chronischer Wunden oder treten als Komplikation während deren Behandlung auf. Neben Debridement und Wundreinigung sind zusätzliche therapeutische Maßnahmen notwendig, um die Gefahr von Infektionen zu senken. Daher werden für die Behandlung chronischer Wunden immer häufiger Wundverbände mit antimikrobiellen Substanzen wie Silber, Povidon-Iod oder Polihexanid eingesetzt. Polihexanid wird dabei aufgrund seiner geringen Zytotoxizität und guten Hautverträglichkeit bevorzugt verwendet. Bei In-vivo-Studien an experimentellen aseptischen Hautwunden von Schweineferkeln konnte sogar ein positiver Effekt von Polihexanid auf den Wundverschluss demonstriert werden. Darüber hinaus ist es in der Lage, die Zellproliferation in vitro zu stimulieren.
In-vitro-Testsysteme bieten die Möglichkeit den Einfluss von Substanzen oder Materialien auf Zellen zu messen. Dabei werden die komplexen Verhältnisse in vivo umgangen und stattdessen definierte Kulturbedingungen genutzt, die eine direkte Beurteilung des Effekts auf Viabilität und Proliferation der Zellen zulassen. Außerdem können in vitro das anti-oxidative Potential gemessen und die antimikrobielle Aktivität von Substanzen bestimmt werden. Darüber hinaus wurde ein Co-Kultursystem aus HaCaT-Keratinozyten und Staphylococcus aureus genutzt um zu testen, ob Polihexanid einen protektiven Einfluss bei einer Infektion hat.
Obwohl Antiseptika im Vergleich zu Antibiotika ein geringeres Potential besitzen, bakterielle Resistenzen zu induzieren, gibt es aufgrund ihres immer breiteren Einsatzes wirkstoffabhängig Bedenken. Daher wurde ein experimentelles System basierend auf der Mikroplatten-Laser-Nephelometrie entwickelt, um eine mögliche Adaption von Staphylococcus aureus an Polihexanid bei wiederholter Inkubation zu untersuchen.
Schlüsselwörter
HaCaT-Keratinozyten, Polihexanid, Staphylococcus aureus, Wundinfektion
Einleitung
Die intakte Haut bildet eine physikalische Barriere. Wenn die Haut verletzt wird, können Mikroorganismen eindringen und sich ungehindert in der feuchtwarmen, nährstoffhaltigen Umgebung vermehren [1]. Die mikrobielle Kontamination von Wunden ist nicht zu verhindern. Bei ungünstigen Umständen kann sich die Kontamination jedoch zu einer kritischen Kolonisation ausweiten und schließlich zu einer lokalen Wundinfektion führen [2]. Infektionen sind eine häufige Ursache für die Entstehung chronischer Wunden. Die Mikroorganismen führen in der Wunde zu einer Stimulation der inflammatorischen Reaktion. Sie induzieren die Migration von Monozyten, Makrophagen und Leukozyten, die zunächst in der notwendigen Weise funktionieren, bei lang anhaltender Stimulation aber zu einer Schädigung des umliegenden Gewebes führen [3]. Es konnte gezeigt werden, dass chronische Wunden mit unterschiedlichen Mikroorganismen kolonisiert sind [4]. Bei der Therapie von chronischen Wunden ist daher auch immer eine lokale antimikrobielle Behandlung notwendig, um pathogene Mikroorganismen, die die Wundheilung behindern, abzutöten [5]. Verschiedene chemische Verbindungen sind zu diesem Zweck erhältlich [6], die sich aufgrund von Substanzklasse, Rezeptur und Konzentration sowohl in ihrer antimikrobiellen Aktivität als auch in ihrer Zytotoxizität unterscheiden. Polyhexamethylbiguanidhydrochlorid (PHMB, Polihexanid) wird zurzeit aufgrund der positiven Ergebnisse in Studien zur Gewebekompatibilität [7], [8], [9], [10] und der klinischen Erfahrungen [11], [12], [13], [14], [15], [16], [17], [18], [19] als das am besten geeignete Antiseptikum für den Einsatz bei chronischen Wunden erachtet. Es konnte gezeigt werden, dass es gegen ein breites Spektrum von Mikroorganismen [6], [20] ebenso wirksam ist wie gegen das Human-Immunodeficieny-Virus [21]. Als kationische Substanz interagiert Polihexanid mit den sauren Lipiden bakterieller Membranen, was zu Funktionsstörungen führt, während die neutralen Lipide humaner Zellmembranen nur geringfügig beeinflusst werden [22]. Aufgrund dieses spezifischen Wirkungsmechanismus ist das zytotoxische und irritative Potential von Polihexanid deutlich niedriger als das anderer Antiseptika [7], [23]. In-vitro-Testsysteme bieten die Möglichkeit den Einfluss von Substanzen oder Materialien auf Zellen zu messen. Dabei werden die komplexen Verhältnisse in vivo umgangen und stattdessen definierte Kulturbedingungen genutzt, die eine direkte Beurteilung des Effekts auf Viabilität und Proliferation der Zellen zulassen. Außerdem können in vitro das antioxidative Potential gemessen und die antimikrobielle Aktivität von Substanzen bestimmt werden.
In einem Co-Kultursystem aus HaCaT-Keratinozyten und Staphylococcus aureus kann getestet werden, ob Antiseptika einen protektiven Effekt besitzen. Obwohl Antiseptika im Vergleich zu Antibiotika ein geringeres Potential besitzen, Resistenzen zu induzieren, gibt es aufgrund des immer breiteren Einsatzes von Antiseptika Wirkstoff abhängig Bedenken, das sich bakterielle Resistenzen entwickeln könnten. Mit Hilfe eines auf der Mikroplatten-Laser-Nephelometrie basierenden In-vitro-Systems wurde die Adaptionsfähigkeit von Staphylococcus aureus bei wiederholter Inkubation mit Polihexanid untersucht.
Material und Methoden
Das antioxidative Potential von Polihexanid (Cosmocil®, ARCH Chemicals) und einer Wundauflage mit Polihexanid (Suprasorb® X+PHMB, Lohmann & Rauscher) wurde mit Hilfe des chemilumineszenten ABEL® Antioxidant Test Kits mit Pholasin® spezifisch für Superoxidanionen und Peroxynitritanionen (Knight Scientific Limited, UK) gemessen.
In der Co-Kultur wurden HaCaT-Keratinozyten mit steigenden Staphylococcus aureus Konzentrationen infiziert und mit oder ohne den Zusatz von Polihexanid in unterschiedlichen Konzentrationen inkubiert. Viabilität und Proliferation der HaCaT-Zellen wurden mit Hilfe des ATPLite™-M Kit (Perkin Elmer) untersucht. Der ATP-Assay basiert auf der Messung des in der ATP-abhängigen enzymatischen Reaktion von D-Luciferin zu Oxy-Luciferin produzierten Lichts. Um zwischen lebenden und toten Zellen unterschieden zu können, wurden die Zellen mit SYTO-13 und Ethidiumhomodimer-2 (Molecular Probes, U.S.) gefärbt und unter dem Mikroskop evaluiert (analySIS® 3.1 Soft Imaging System GmbH, Germany). Staphylococcus aureus wurde durch Färbung mit SYTO-9 (Molecular Probes) quantifiziert.
Für die Messung des Adaptionspotentials wurde Staphylococcus aureus mit Polihexanid bzw. mit Silbernitrat inkubiert. Das Bakterienwachstum wurde mit Hilfe eines Mikrotiterplatten-Laser-Nephelometers (NepheloSTAR, BMG Labtech, Germany) untersucht und die IC50-Konzentrationen der Antiseptika bestimmt. Danach erfolgte die wiederholte Inkubation der Mikroorganismen mit 0,2 µg/mL Polihexanid und 5 µg/mL Silbernitrat für einen Zeitraum von 100 d. Der Einfluss der wiederholten Inkubation mit den Antiseptika wurde durch die Berechnung des IC50-Wertes verfolgt. Zusätzlich wurde eine Polihexanid haltige Wundauflage (Suprasorb® X + PHMB, Lohmann & Rauscher) entsprechend dem JIS L 1902:2002 Standard für antibakterielle Aktivität gegen unbehandelten und behandelten S. aureus getestet Für die Testung wurden pro Ansatz 400 mg der Wundauflage eingewogen. Als Referenzmaterial diente Polyester. Die Proben wurden mit unbehandeltem und behandeltem Staphylococcus aureus für 6 h bzw. 24 h bei 37°C unter aeroben Bedingungen inkubiert. Für die Keimzahlbestimmung wurden die Teststücke in Kochsalzlösung (0,9%-ig, mit Tween20) extrahiert. Von den Extrakten wurden Verdünnungsreihen hergestellt, ausplattiert und für 24 h inkubiert. Danach erfolgten das Auszählen der Kolonien auf den Platten und die Berechnung der cfu (colony forming units) entsprechend dem JIS L 1902:2002 im Vergleich zum Anfangswert: Wachstumsreduktion [log] = log(24hMW [cfu]KontrollePolyester)–log(24hMW [cfu]Probe). Die Beurteilung der antimikrobiellen Aktivität ergibt sich aus der Reduktion des mikrobiellen Wachstums durch die Probe: Wachstumsreduktion <0,5 log = keine antimikrobielle Aktivität, Wachstumsreduktion >0,5–<1 log = geringe antimikrobielle Aktivität, Wachstumsreduktion >1–≤3 log = signifikante antimikrobielle Aktivität und Wachstumsreduktion >3 log = starke antimikrobielle Aktivität.
Ergebnisse
Freie Radikale spielen eine wichtige Rolle in der Wundheilung. Sie erhöhen die bakteriozide Aktivität und modulieren verschiedene Funktionen wie die Vasodilatation, die Bildung von Granulationsgewebe, die Reepithelisierung und die Umbildung der extrazellulären Matrix. Die Überproduktion von ROS (reactive oxygen species) und RNS (reactive nitrogen species) hat jedoch negative Effekte und kann zur Schädigung von Zellen und Gewebe führen. Polihexanid besitzt ein signifikantes, konzentrationsabhängiges antioxidatives Potential (Abbildung 1 [Abb. 1]). Die Polihexanid haltige Wundauflage war ebenfalls in der Lage, die Bildung von ROS und RNS signifikant zu inhibieren (Abbildung 2 [Abb. 2]).
Abbildung 1: Konzentrationsabhängige Inhibition der Radikalbildung durch Polihexanid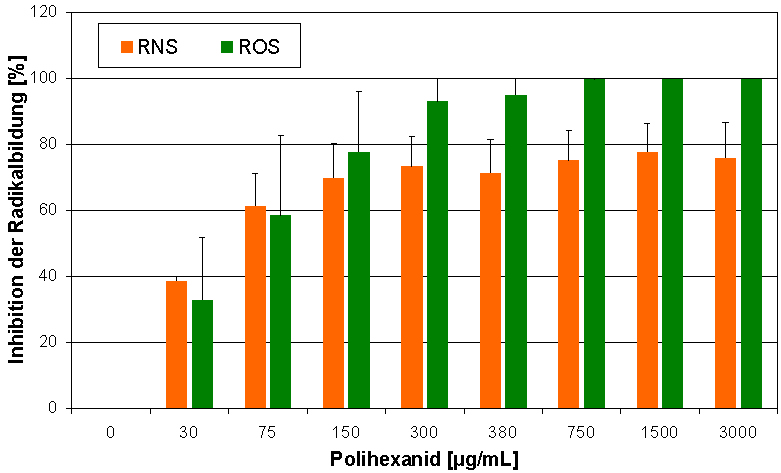
Abbildung 2: Antioxidative Wirkung einer Polihexanidhaltigen Wundauflage aus Biocellulose (Suprasorb® X + PHMB, Lohmann & Rauscher)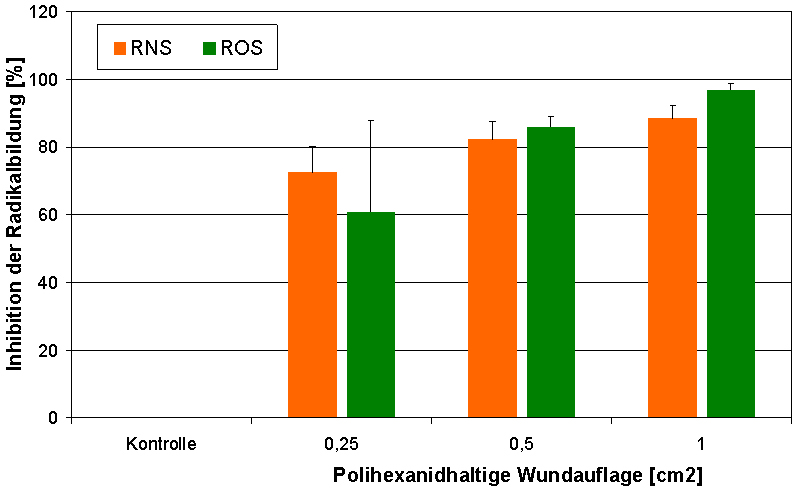
Eine Co-Kultur von HaCaT-Keratinozyten und Staphylococcus aureus stellt ein wertvolles Modell für infizierte Zellen in einer Wunde dar. Steigende Staphylococcus aureus-Konzentrationen hatten einen negativen Effekt auf die HaCaT-Zellviabilität und Proliferation (Abbildung 3 [Abb. 3]). Polihexanid war in der Lage, die Schädigung der Zellen zu verhindern und die normale Zellproliferation wieder herzustellen (Abbildung 4 [Abb. 4]). Dieser Effekt wird durch die Reduktion der Bakterienzahl erzielt (Abbildung 5 [Abb. 5]). Um in der Co-Kultur zwischen lebenden und toten Zellen unterschieden zu können, wurden die Keratinozyten mit SYTO-13 und Ethidiumhomodimer-2 gefärbt (Abbildung 6 [Abb. 6]). Der Extrakt der PHMB-haltigen Wundauflage ist ebenfalls in der Lage, die Bakterienzahl zu reduzieren (Abbildung 7 [Abb. 7]) und die Zellen vor der bakteriellen Schädigung zu schützen (Abbildung 8 [Abb. 8] und Abbildung 9 [Abb. 9]).
Abbildung 3: Steigende Staphylococcus aureus-Konzentrationen haben einen negativen Effekt auf die HaCaT-Zellviabilität und Proliferation (Bestimmung des zellulären ATP-Gehaltes; * p<0,05, ** p<0,01, *** p<0,001).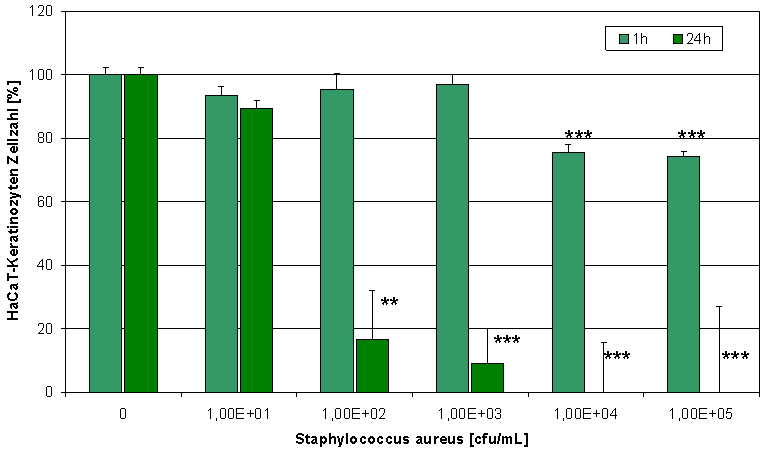
Abbildung 4: Polihexanid (1 µg/mL) ist in der Lage, die normale Zellproliferation wieder herzustellen (Bestimmung des zellulären ATP-Gehaltes; * p<0,05).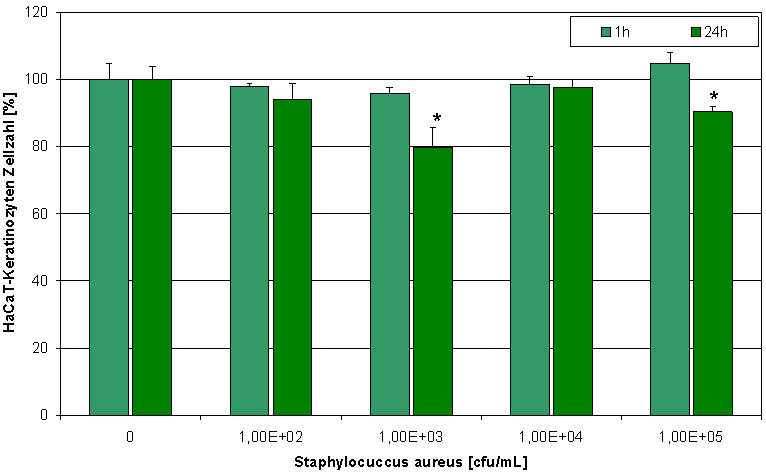
Abbildung 5: In der Co-Kultur zeigt Polihexanid einen konzentrationsabhängigen antimikrobiellen Effekt (Messung der Fluoreszenzintensität von SYTO-9; * p<0,05, ** p<0,01, *** p<0,001).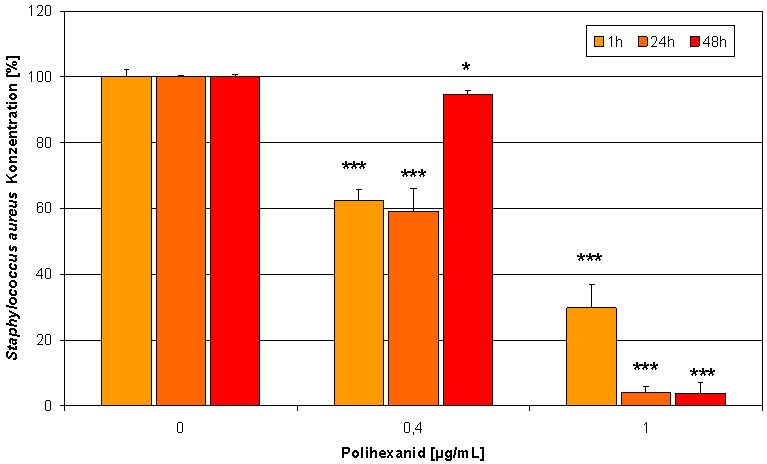
Abbildung 6: Lebend/Tot-Färbung der HaCaT-Keratinozyten in Co-Kultur mit SYTO-13 und Ethidiumhomodimer-2 (A: HaCaT-Kontrolle ohne S. aureus nach 1 h; B: HaCaT-Kontrolle ohne S. aureus nach 48 h; C: HaCaT-Zellen + 10E2 cfu/mL S. aureus nach 1 h; D: HaCaT-Zellen + 10E2 cfu/mL S. aureus nach 48 h; E: HaCaT-Zellen + 10E2 cfu/mL S. aureus + 1 µg/mL Polihexanid nach 1 h; F: HaCaT-Zellen + 10E2 cfu/mL S. aureus + 1 µg/mL Polihexanid nach 48 h).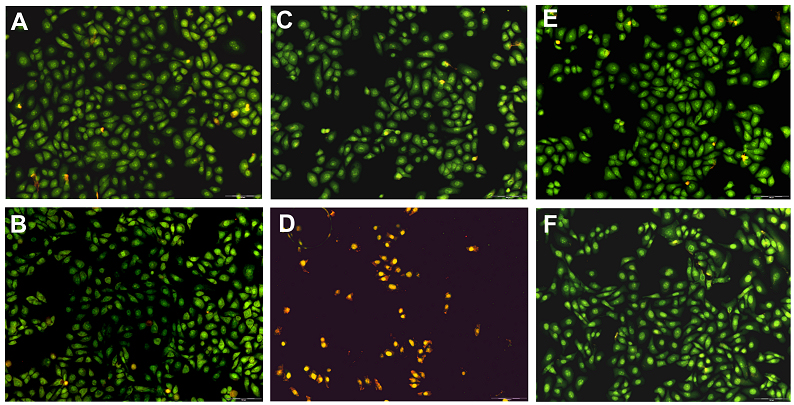
Abbildung 7: Der Extrakt von Suprasorb® X + PHMB hat eine signifikante antimikrobielle Wirkung (Messung der Fluoreszenzintensität von SYTO-9; *** p<0,001).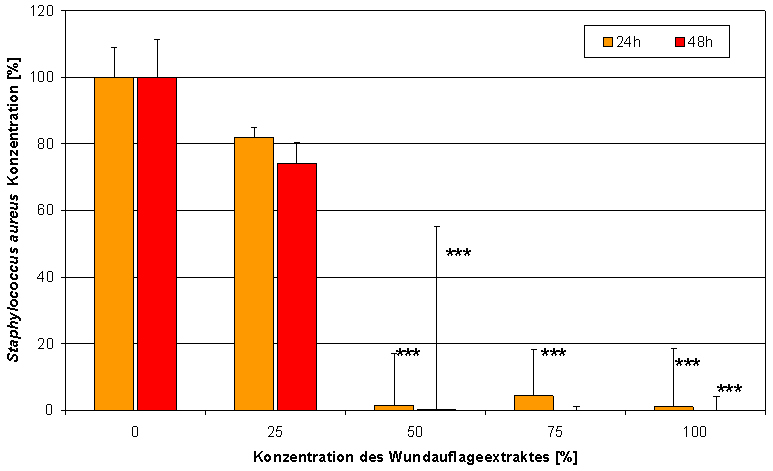
Abbildung 8: Der Extrakt der Wundauflage Suprasorb® X + PHMB schützt die humanen Zellen in Co-Kultur mit Staphylococcus aureus vor der bakteriellen Schädigung (Bestimmung des zellulären ATP-Gehaltes; * p<0,05; ** p<0,01; *** p<0,001).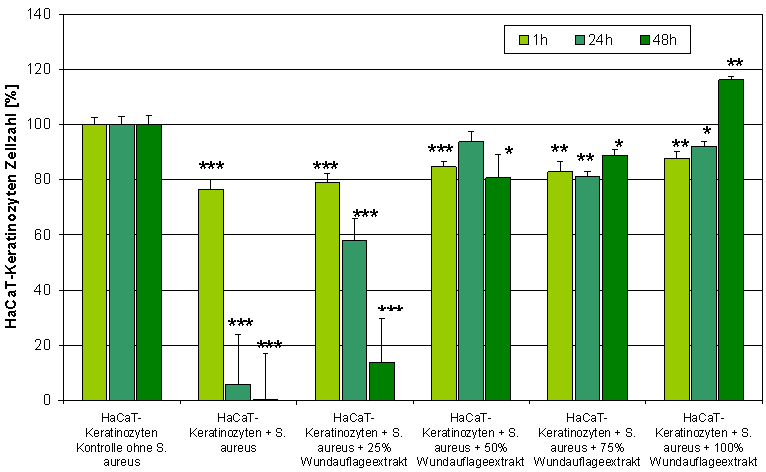
Abbildung 9: Färbung von HaCaT-Keratinozyten in Co-Kultur mit SYTO-13 und Ethidiumhomodimer-2 (A: HaCaT-Kontrolle ohne S. aureus nach 1 h; B: nach 24 h; C: nach 48 h; D: HaCaT-Zellen + 10E2 cfu/mL S. aureus nach 1 h; E: nach 24 h; F: nach 48 h; G: HaCaT-Zellen + 10E2 cfu/mL S. aureus + Suprasorb® X + PHMB Extrakt nach 1 h; H: nach 24 h; I: nach 48 h).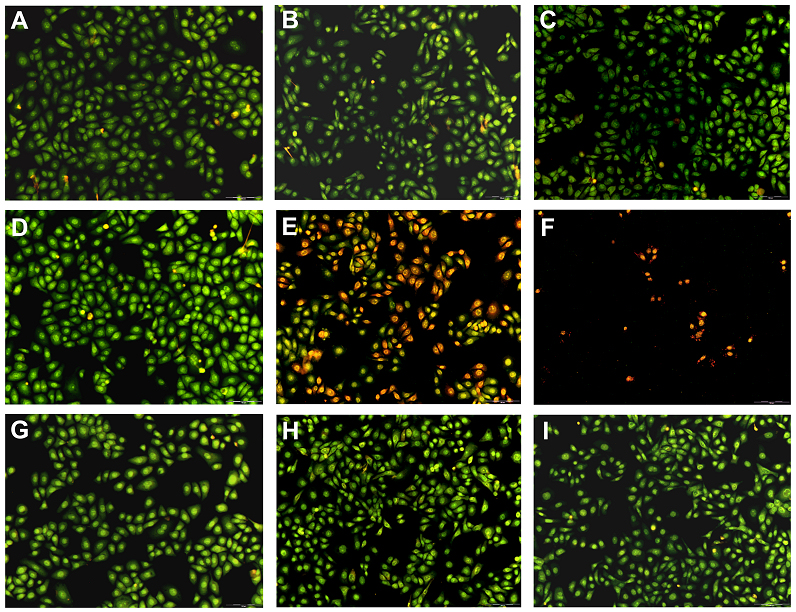
Die Lasernephelometrie wurde genutzt, um die Adaptionsfähigkeit von Staphylococcus aureus bei wiederholter Inkubation mit Polihexanid im Vergleich zu Silbernitrat zu testen. Bei der Lasernephelometrie handelt es sich um ein optisches Analyseverfahren, mit dem sich die Konzentration von Teilchen in Flüssigkeiten quantitativ bestimmen lässt. Die in der Lösung suspendierten Partikel streuen das einfallende Licht seitlich zum Lichtstrahl (Tyndall-Effekt). Diese Methode ermöglicht die Messung mikrobieller Wachstumskurven, indem die Trübung der Lösung bestimmt wird. Aufgrund der hohen Sensitivität der Technik ist es möglich, bereits geringe Konzentrationen streuender Partikel, wie es in der lag-Phase und dem Anfang der log-Phase der Falls ist, zu erfassen. Der Einfluss der wiederholten Inkubation mit den Antiseptika wurde durch die Berechnung des IC50-Wertes verfolgt. Die IC50-Konzentrationen für Polihexanid stiegen über den Versuchszeitraum nur geringfügig an (Abbildung 10 [Abb. 10]). Im Gegensatz dazu wurde eine Zunahme des IC50-Wertes für Silbernitrat beobachtet (Abbildung 10 [Abb. 10]). Bei der Testung auf antibakterielle Aktivität entsprechend dem JIS L 1902 wies die Polihexanid haltige Wundauflage eine vergleichbare Wirkung gegenüber behandeltem und unbehandeltem S. aureus auf (Abbildung 11 [Abb. 11]).
Abbildung 10: Verlauf der IC50-Konzentration bei wiederholter Inkubation von Staphylococcus aureus mit Polihexanid und Silbernitrat über 100 d.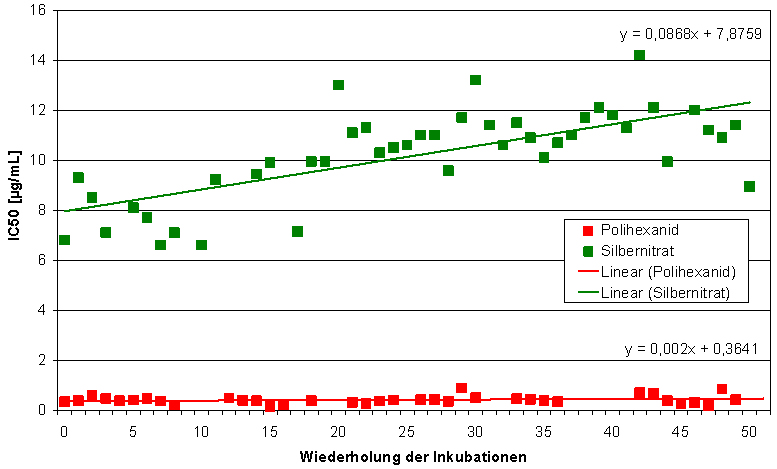
Abbildung 11: Bestimmung der antibakteriellen Aktivität der Polihexanidhaltigen Wundauflage Suprasorb® X + PHMB nach dem JIS L 1902 gegen unbehandelten und behandelten Staphylococcus aureus (Mittelwert ± Standardfehler).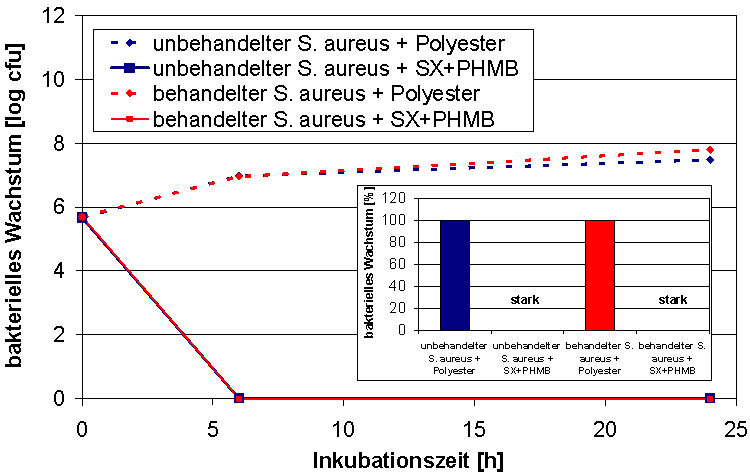
Diskussion
Die Anwesenheit von Mikroorganismen in Wunden beeinflusst in hohem Maß die Balance von ab- und aufbauenden Prozessen. Chronische Wunden sind vor allem mit Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa, coagulase-negativen Staphylokokken, Proteus-Spezies und anaeroben Bakterien kolonisiert [24], [25]. Staphylococcus aureus wird als besonders problematisch bei Infektionen von traumatischen, chirurgischen und Brandwunden eingeschätzt, da er in diesen besonders häufig vorkommt [1]. Darüber hinaus besitzt Staphylococcus aureus eine Reihe von Resistenzen gegen Antibiotika (z.B. MRSA, Methicillinresistenter S. aureus) und stellt damit nicht nur bei der Wundbehandlung [24], sondern auch in anderen klinischen Bereichen, z.B. der Therapie von atopischer Dermatitis [26], ein wachsendes Problem dar. Da davon ausgegangen wird, dass Antiseptika ein geringeres Potential besitzen, Resistenzen zu induzieren als Antibiotika, werden sie immer häufiger für die Behandlung von infizierten chronischen Wunden eingesetzt. Die Reduktion der bakteriellen Belastung durch eine antiseptische Behandlung kann die Zeit bis zum Wundverschluss verkürzen [13], [21], [27]. Aufgrund der breiten Wirkungsweise von Antiseptika können einige dieser Substanzen aber auch schädigende Einflüsse auf die gesunden Zellen in der Wunde haben. Das Ziel aller Behandlungsstrategien ist demnach, ein Gleichgewicht zwischen dem Abtöten von Bakterien und dem Schutz der Wirtszellen zu erreichen [28]. Das beste Antiseptikum ist daher das, welches die höchste antimikrobielle Aktivität mit der geringsten lokalen oder systemischen Toxizität zeigt [7]. Polihexanid wird in einer Vielzahl von Produkten eingesetzt, wie Wundauflagen, Kontaktlinsenreinigunslösungen, perioperativen Reinigungslösungen, aber auch als Schwimmbadreiniger [3], [9], [10], [29]. Polihexanid interagiert mit den sauren Lipiden in den mikrobiellen Membranen und führt zu deren Funktionsstörung. Es konnte gezeigt werden, dass Polihexanid eine Aggregation der sauren Lipide in dem Adsorptionsbereich hervorruft [30]. Das verändert die Membranpermeabiliät und die Funktion membranassoziierter Enzyme [6], [30]. Im Gegensatz dazu werden die neutralen Lipide humaner Zellmembranen nur geringfügig beeinflusst [22]. Aufgrund dieses Unterschieds sind die Zytotoxizität und das irritative Potential von Polihexanid geringer als das anderer Antiseptika [7], [23]. Darüber hinaus konnte ein positiver Effekt auf den Wundverschluss in vivo [7], [12] und auf die Proliferation von Zellen in vitro [31] beobachtet werden.
In-vitro-Modelle stellen eine wertvolle Ergänzung zu klinischen Studien und in vivo Beobachtungen dar, da sie durch den Einsatz genau definierter Versuchsbedingungen die komplexen Vorgänge in vivo vereinfachen und eine direkte Beobachtung der von der Substanz hervorgerufenen Effekte ermöglichen. So konnte z.B. in einem In-vitro-System gezeigt werden, dass Polihexanid die Bildung freier Radikale inhibiert. Die Überproduktion von reaktiven Sauerstoff- und Stickstoffspezies in chronischen Wunden führt zu einer Verlängerung der inflammatorischen Phase und einer Schädigung des Gewebes [32]. Die Reduktion dieser aktiven Spezies stellt daher eine Möglichkeit dar, die normale Wundheilung zu unterstützen. Sowohl Polihexanid als auch die untersuchte Polihexanid haltige Wundauflage sollten also aufgrund ihres antioxidativen Potentials neben der antimikrobiellen Wirkung noch einen zusätzlichen positiven Effekt auf die Wundheilung haben. Die Ergebnisse der Untersuchungen an einer Co-Kultur von HaCaT-Keratinozyten mit Staphylococcues aureus zeigen außerdem, dass Polihexanid nicht nur antimikrobiell wirksam sondern auch in der Lage ist, humane Zellen vor der Schädigung durch Bakterien zu schützen.
Im Gegensatz zu Antiseptika und Wundspüllösungen haben Wundauflagen eine viel längere Verweildauer auf der Wunde. Dementsprechend sind hier mögliche toxische Effekte von viel größerer Bedeutung. Es konnte gezeigt werden, dass die Zytotoxizität der Polihexanid haltigen Wundauflage sehr gering ist und damit eine hohe Sicherheit für den Anwender hat [33]. Die Ergebnisse der Untersuchung der Wundauflage in dem Co-Kultursystem bestätigen diese Schlussfolgerungen. Der Extrakt der Wundauflage hatte einen protektiven Effekt auf die mit Staphylococcus aureus infizierten Keratinozyten. Die Wundauflage ist also in der Lage, die Bakterienzahl in der Wunde zu reduzieren und den Heilungsprozess zu unterstützen. Die zunehmende Nutzung von Antiseptika und ihr immer breiterer Einsatz in Wundauflagen könnten jedoch im Falle einer Resistenzentwicklung zu einer Abnahme der Wirkung gegenüber Bakterien führen. Silberwundauflagen besitzen antibakterielle und antimykotische Eigenschaften, die Entwicklung einer Resistenz auf Silber ist jedoch möglich. Erste Ergebnisse einer dementsprechenden Studie konnten zeigen, dass die IC50-Konzentration für Silbernitrat während der wiederholten Exposition von S. aureus ansteigt. Silberhaltige Wundauflagen, die Silber-Ionen in die Wunde freisetzen, sollten daher und auch auf Grund der damit verbundenen Zytotoxizität [34], [35], [36] kurzfristig und nicht permanent bei kritisch-kolonisierten oder infizierten Wunden verwendet werden. Im Gegensatz dazu besitzt Polihexanid in dem verwendeten experimentellen System ein sehr viel geringeres Potential, eine Adaption in Staphylococcus aureus zu induzieren.
Die In-vitro-Evaluierung hat positive Effekte von Polihexanid auf die Zellen, eine geringe Zytotoxizität und ein niedriges Potential zur Induktion bakterieller Adaption bei gleichzeitig hoher antimikrobieller Aktivität aufzeigen können. Polihexanid scheint also eine geeignete Substanz für die Behandlung chronischer Wunden zu sein.
Literatur
[1] Bowler PG, Duerden BI, Armstrong DG. Wound microbiology and associated approaches to wound management. Clin Microbiol Rev. 2001;14(2):244-69. DOI: 10.1128/CMR.14.2.244-269.2001[2] Kingsley A. The wound infection continuum and its application to clinical practice. Ostomy Wound Manag. 2003;49(7 suppl A):1-7.
[3] Warriner R, Burell R. Infection and the chronic wound: a focus on silver. Adv Skin Wound Care. 2005;18(Suppl 1):2-12. DOI: 10.1097/00129334-200510001-00001
[4] White RJ, Cutting K, Kingsley A. Topical antimicrobials in the control of wound bioburden. Ostomy Wound Manag. 2006;52(8):26-58.
[5] Bowler PG. Wound pathophysiology, infection and therapeutic options. Ann Med. 2002;34(6):419-27. DOI: 10.1080/078538902321012360
[6] McDonnel G, Russel AD. Antiseptics and disinfectants: activity, action and resistance. Clin Microbiol Rev. 1999;12(1):147-79.
[7] Kramer A, Adrian V, Rudolph P, Wurster S, Lippert H. Explantationstest mit Haut und Peritoneum der neonatalen Ratte als Voraussagetest zur Verträglichkeit lokaler Antiinfektiva für Wunden und Körperhöhlen. Chirurg. 1998;69:840-5. DOI: 10.1007/s001040050498
[8] Kramer A, Roth B, Müller G, Rudolph P, Klöcker N. Influence of the antiseptic-agents polihexanide and octenidine on FL cells and on healing of experimental superficial aseptic wounds in piglets. Skin Pharmacol Physiol. 2004;17:141-6. DOI: 10.1159/000077241
[9] Kalteis T, Luring C, Schaumburger J, Perlick L, Bathis H, Rifka J. Gewebetoxizität lokaler Antiseptika [Tissue toxicity of antiseptics]. Z Orthop Ihre Grenzgeb. 2003;141:233-8. DOI: 10.1055/s-2003-38654
[10] Kramer A, Roth B. Polihexanid. In: Kramer A, Assadian O, editors. Wallhäußers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung. Stuttgart: Thieme Verlag; 2008. p. 789-93.
[11] Schmit-Neuerburg KP, Bettag C, Schlickewei W, et al. Wirksamkeit eines neuartigen Antiseptikums in der Behandlung kontaminierter Weichteilwunden. Chirurg. 2001;72:61-71. DOI: 10.1007/s001040051269
[12] Daeschlein G, Assadian O, Bruck JC, Meinl C, Kramer A, Koch S. Feasibility and clinical applicability of polihexanide for treatment of second-degree burn wounds. Skin Pharmacol Physiol. 2007;20:292-6. DOI: 10.1159/000107577
[13] Hansmann F, Kramer A, Ohgke H, Strobel H, Muller M, Geerling G. Polyhexamethylbiguanid (PHMB) zur präoperativen Antisepsis bei Kataraktoperation [Polyhexamethylbiguanid (PHMB) as preoperative antiseptic for cataract surgery]. Opthalmologe. 2004;101:377-83. DOI: 10.1007/s00347-003-0933-9
[14] Mulder GD, Cavorsi JP, Lee DK. Polyhexamethylene biguanidine (PHMB): an addendum to current topical antimicrobials. Wounds. 2007;19(7):173-82.
[15] Fabry W, Trampenau C, Bettag C, Handschin AE, Lettgen B, Huber FX, Hillmeier J, Kock HJ. Bacterial decontamination of surgical wounds treated with Lavasept®. Int J Hyg Environ Health. 2006;209:567-73. DOI: 10.1016/j.ijheh.2006.03.008
[16] Mueller SW, Krebsbach LE. Impact of an antimicrobial-impregnated gauze dressing on surgical site infections including methicillin-resistant Staphylococcus aureus infections. Am J Infect Control. 2008;36:651-5. DOI: 10.1016/j.ajic.2007.12.005
[17] Mosti G, Mattaliano V. First Italian experience with a Hydrobalanced cellulose-based wound dressing on hospital-patients with critically-colonized or locally infected chronic wounds: Poster. In: 18th Conference of the European Wound Management Association (EWMA); 2008 May 14-16; Lisbon, Portugal. 2008.
[18] Wild T, Bruckner M, Heilinger J, Schwarz C, Otto F, Götzinger P. Wundverband aus Biozellulose mit Polyheamethylenbiguanid. Wien Med Wochenschr Skriptum. 2008;5(3):19-20.
[19] Wild T, Bruckner M, Payrich M, Schwarz C, Eberlein T. Prospective randomized study for eradication of MRSA with polyhexanid containing cellulose dressing compared with polyhexanid wound solution. EWMA J. 2009;9(Suppl):170.
[20] Eifler-Bollen R, Fluhr JW. Antimikrobiell wirksame Magistralrezepturen: Stellenwert in der Praxis und kritische Anmerkungen [Antimicrobially effective compounded medications: clinical value and critical comments]. Hautarzt. 2005;56:752-8. DOI: 10.1007/s00105-005-0974-x
[21] Krebs FC, Miller SR, Ferguson ML, et al. Polybiguanides, particularly polyethylene hexamethyl biguanide, have activity against human immunodeficiency virus type 1. Biomed Pharmacother. 2005;59(8):438-45. DOI: 10.1016/j.biopha.2005.07.007
[22] Ikeda T, Tazuke S, Watanabe M. Interaction of biologically active molecules with phospholipid membranes: I. Fluorescence depolarization studies on the effect of polymeric biocide bearing biguanide groups in the main chain. Biochim Biophys Acta. 1983;735:380-6. DOI: 10.1016/0005-2736(83)90152-9
[23] Santodomingo-Rubido J, Mori O, Kawaminami S. Cytotoxicity and antimicrobial activity of six multipurpose soft contact lens disinfecting solutions. Ophthal Physiol Opt. 2006;26:476-82. DOI: 10.1111/j.1475-1313.2006.00393.x
[24] Dissemond J, Schmid EN, Esser S, Witthoff M, Goos M. Bakterielle Kolonisation chronischer Wunden: Untersuchungen in einer universitären dermatologischen Wundambulanz unter besonderer Berücksichtigung von ORSA. Hautarzt. 2004;55:280-8. DOI: 10.1007/s00105-004-0697-4
[25] Gjodsbol K, Christensen JJ, Karlsmark T, Jorgensen B, Klein BM, Krogfelt KA. Multiple bacterial species reside in chronic wounds: a longitudinal study. Int Wound J. 2006;3(3):225-31. DOI: 10.1111/j.1742-481X.2006.00159.x
[26] Niebuhr M, Mai U, Kapp A, Werfel T. Antibiotic treatment of cutaneous infections with Staphylococcus aureus in patients with atopic dermatitis: current antimicrobial resistances and susceptibilities. Exp Dermatol. 2008;17:953-7. DOI: 10.1111/j.1600-0625.2008.00734.x
[27] Robson MC. Bacterial control in burn wound. Clin Plast Surg. 1979; 6:515.
[28] Cooper ML, Laxer JA, Hansbrough JF. The cytotoxic effects of commonly used topical antimicrobial agents on human fibroblasts and keratinocytes. J Trauma. 1991;31(6):775-84. DOI: 10.1097/00005373-199106000-00007
[29] Dissemond J, Gerber V, Kramer A, Riepe G, Strohal R, Vasel-Biergans A, Eberlein T. Praxisorientierte Expertenempfehlung zur Behandlung kritisch kolonisierter und lokal infizierter Wunden mit Polihexanid [Practice-oriented recommendation for the treatment of critical colonised and local infected wounds using polihexanide]. Z Wundheilung. 2009;14:20-6.
[30] Ikeda T, Ledwith A, Bamford CH, Hann RA. Interaction of a polymeric biguanide biocide with phospholipids membranes. Biochim Biophys Acta. 1984;769:57-66. DOI: 10.1016/0005-2736(84)90009-9
[31] Wiegand C, Abel M, Kramer A, Müller G, Ruth P, Hipler UC. Proliferationsförderung und Biokompatibilität von Polihexanid. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc43. Available from: http://www.egms.de/en/journals/dgkh/2007-2/dgkh000076.shtml
[32] Moseley R, Stewart JE, Stephens P, Waddington RJ, Tomas DW. Extracellular matrix metabolites as potential biomarkers of disease activity in wound fluid: lessons learned from other inflammatory diseases? Br J Dermatol. 2004;150:401-13. DOI: 10.1111/j.1365-2133.2004.05845.x
[33] Seipp HM, Körber A. Biofilm, fibrin, resistance - antibacterial measures with focus on polihexanide; Presentation. In: 18th Conference of the EWMA; 2008 May 14-16; Lisbon/Portugal.
[34] Hidalgo E, Bartolome R, Barroso C, Moreno A, Dominguez C. Silver nitrate: antimicrobial activity related to cytotoxicity in cultured human fibroblasts. Skin Pharmacol Appl Skin Physiol. 1998;11:140-51. DOI: 10.1159/000029820
[35] Paddle-Ledinek JE, Nasa Z, Cleland HJ. Effect of different wound dressings on cell viability and proliferation. Plast Reconstr Surg. 2006;117(Suppl):110S-8S. DOI: 10.1097/01.prs.0000225439.39352.ce
[36] Müller G, Kramer A. Biocompatibility index of antiseptic agents by parallel assessment of antimicrobial activity and cellular cytotoxicity. J Antimicrob Chemother. 2008;61:1281-7. DOI: 10.1093/jac/dkn125




