In vitro-Wirksamkeit von Octenidin und Polihexanid gegen Biofilme aus Pseudomonas aeruginosa im Labor
Nadine Harbs 1Jörg Siebert 1
1 Schülke & Mayr GmbH, Norderstedt, Deutschland
Zusammenfassung
Die Ablösung und Inaktivierung von Biofilmen durch Wundspüllösungen ohne bzw. mit Zusatz antimikrobieller Stoffe (Octenidindihydrochlorid, Polihexanid) wurde in einem Labormodell mit Pseudomonas aeruginosa untersucht. Hierzu wurden mit P. aeruginosa über 1 Woche bewachsene Objektträger aus Polycarbonat für 60 min den Prüflösungen ausgesetzt und nachfolgend die Ablösung bzw. Inaktivierung des Biofilms mittels Anfärbung mit Kristallviolett bzw. Verdünnungsreihe und Keimzahlbestimmung ermittelt.
Im Ergebnis kam es zu keiner Hemmung der Ablösung (Reinigung) durch den Zusatz von Octenidin bzw. Polihexanid. Im Gegensatz zu den reinen Salzlösungen (NaCl, Ringer) wurde durch Zusatz der antimikrobiellen Wirkstoffe eine deutliche Reduktion der Koloniezahl im Biofilm erreicht.
Schlüsselwörter
Biofilm, Wundspüllösung, Ablösung, Inaktivierung, Octenidindihydrochlorid, Polihexanid
Einleitung
Biofilme stellen komplexe Lebensgemeinschaften von Mikroorganismen auf den vielfältigsten unbelebten (z.B. Kathetern, Implantate) und belebten Oberflächen (z.B. Wunden) dar. Die von den Mikroorganismen im Zuge ihres Stoffwechsels ausgeschiedenen extrapolymeren Substanzen (EPS) vermitteln die Anheftung von Mikroorganismen, sorgen für deren Ernährung, geben dem Biofilm seine Form und Eigenschaften und stabilisieren ihn gleichzeitig [1].
Da Biofilme ihren Bewohnern gleichzeitig Schutz vor externen Einflüssen (z.B. dem Angriff von Antibiotika) verleihen sowie das Auftreten und die Persistenz von Infektionen fördern können [2], muss es das Anliegen sein, Biofilme möglichst schnell und effektiv abzulösen und die darin enthaltenen Mikroorganismen abzutöten.
Wundspüllösungen, d.h. mit bzw. ohne antiseptischen Wirkstoff versehene Salzlösungen, werden häufig unterstützend zur Reinigung kontaminierter, kolonisierter und belegter Wunden eingesetzt. Es sollte untersucht werden, inwieweit verschiedene Wundspüllösungen in der Lage sind, unter experimentellen Bedingungen einen standardisierten, artifiziellen Biofilm aus Pseudomonas aeruginosa von einer unbelebten Oberfläche abzulösen und zu inaktivieren.
Methoden
Für die Anzucht des artifiziellen Biofilms wurden Polycarbonat-Objektträger (76 x 26 x 1 mm, Fa. Buck & Sohn, Hamburg) in einem „Biofilm-Reaktor“ (Abbildung 1 [Abb. 1]) über insgesamt 1 Woche mit 1 l einer mit Pseudomonas aeruginosa beimpften Nährlösung bei einer Fließgeschwindigkeit von 3 ml/min im Kreislauf inkubiert.
Abbildung 1: Aufsicht auf einen Biofilm-Reaktor bestückt mit Objektträgern zur Herstellung der Biofilme

Zur Prüfung der Reinigungsleistung wurden die so mit dem Biofilm bewachsenen Objektträger 60 min in die jeweilige Wundspüllösung eingetaucht. Nach Herausnahme und Trocknung wurden die verbliebenen Biofilmreste auf den Objektträgern in Färbeküvetten für 15 min mit 0,1% Kristallviolett angefärbt. Nach Extraktion des Farbstoffes aus dem angefärbten Biofilm mittels 96% Ethanol wurde 3 min bei 3000 rpm zentrifugiert und der Gehalt im Überstand photometrisch bei 585 nm bestimmt. Im Ergebnis war die Extinktion umso geringer, desto weniger Biofilm auf den Objektträgern nach Behandlung verblieben war.
Für die Bestimmung der Inaktivierung wurden die Objektträger nach der einstündigen Inkubation mit der Wundspüllösung in CSL-Bouillon mit Inaktivierungssubstanzen (Tween 80, Lecithin, Saponin, Histidin) überführt und zur Ablösung und Homogenisierung des Biofilms 60 s im Ultraschall behandelt. Aus dieser Lösung erfolgte mittels Verdünnungsreihe, Ausplattieren und Auszählung der Kolonien die Koloniezahlbestimmung.
Alle Messungen wurden in 3 Parallelen durchgeführt.
Folgende Wundspüllösungen wurden zur Prüfung verwendet:
- 0,05% Octenidin-Lösung
- 0,02% Polihexanid-Lösung
- Ringer-Lösung
- NaCl-Lösung (0,9%)
Aqua bidest. wurde als Kontrolle verwendet.
Der Reduktionsfaktor (RF) wurde aus der Differenz lg Nachwert – lg Vorwert der Anzahl koloniebildender Einheiten berechnet.
Ergebnisse
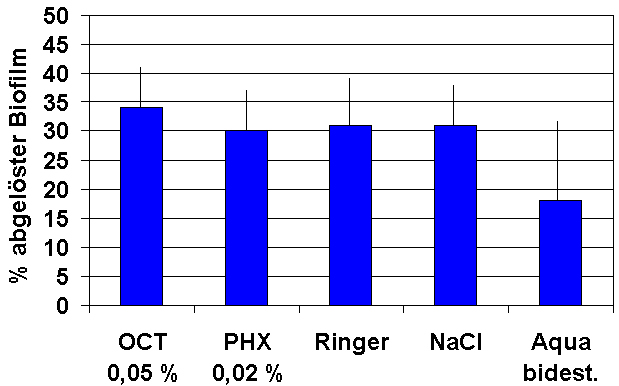
Unabhängig von ihrer Zusammensetzung zeigten die Prüflösungen in der gewählten Testanordnung eine Ablösung des Biofilms aus P. aeruginosa (Reinigungsleistung) von im Durchschnitt 31-34%. Damit war die Reinigungsleistung der von aqua bidest. (18%) überlegen (Abbildung 2 [Abb. 2]).
Abbildung 2: Ablösung eines 1 Woche angezüchteten Biofilms von
P. aeruginosa
auf Polycarbonat-Objektträgern nach 60 min Kontakt mit verschiedenen Wundspüllösungen
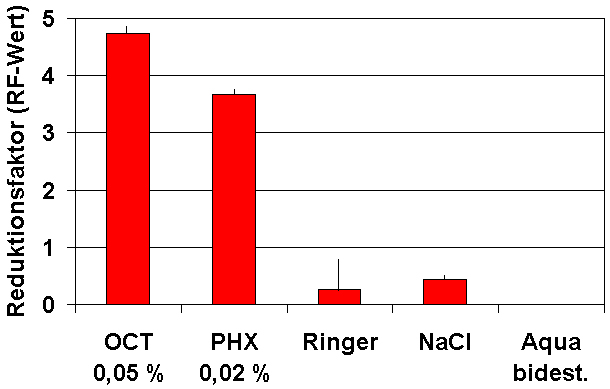
Bei der Inaktivierung der Biofilme war Octenidin mit einem RF-Wert von lg=4,7 dem von Polihexanid überlegen (RF lg=3,7). Erwartungsgemäß zeigten die reinen Salzlösungen hierbei keine relevanten Koloniezahlreduktionen (Abbildung 3 [Abb. 3]).
Abbildung 3: Inaktivierung eines 1 Woche angezüchteten Biofilms von
P. aeruginosa
auf Polycarbonat-Objektträgern nach 60 min Kontakt mit verschiedenen Wundspüllösungen
Diskussion
Die Ergebnisse in dem gewählten Modell zeigen, dass der Zusatz von antimikrobiellen Substanzen (Octenidin, Polihexanid) zu Salzlösungen im Unterschied z.B. zur bekannten Eiweiß-fixierenden Wirkung von Aldehyden [3] keinen negativen Einfluss auf die Ablösung von Biofilmen hat, d.h. es findet keine Fixierung proteinhaltiger Oberflächenbeläge statt.
Der Vorteil der antimikrobiellen Substanzen in den verwendeten Salzlösungen liegt offensichtlich darin, dass die Substanzen in der Lage sind, zusätzlich zum Ablösevermögen der Lösung in den Biofilm einzudringen und die darin enthaltenen Bakterien zu inaktivieren.
Mit der gewählten Methode konnten die Ergebnisse von Seipp et al. [4] nicht bestätigt werden, wonach Salzlösungen nicht in der Lage sind, Biofilme von Oberflächen abzulösen. Diese Diskrepanz kann verschiedene Ursachen haben. So wurden von den Autoren u.a. Silikonschläuche als Oberflächenmaterialien verwendet. Zudem wurde anstatt eines Protein-Nachweises ein Endotoxin-Nachweis als Maß für die Ablösung des Biofilms verwendet. Diese widerspüchlichen Befunde lassen es notwendig erscheinen, vergleichende Untersuchungen unter in vivo-Bedingungen (z.B. in der Wunde) durchzuführen.
Literatur
[1] Costerton JW. The Biofilm Primer - Springer Series on Biofilms. Berlin / Heidelberg: Springer-Verlag; 2007.[2] Costerton JW, Steward PS, Greenberg EP. Bacterial Biofilms: A common cause of persistent infections. Science. 1999;284:1318-22.
[3] Kampf G, Bloss R, Martiny H. Surface fixation of dried blood by glutaraldehyde and peracetic acid. J Hosp Infect. 2004;57(2):139-43.
[4] Seipp HM, Hofmann S, Hack A, Skowronsky A, Hauri A. Wirksamkeit verschiedener Wundspüllösungen gegenüber Biofilmen. ZfW. 2005:160-4.




