[Screeningmethode zur Qualitätsprüfung flächiger Plasmaquellen mit dem Mikroorganismen-Agar-Test (MAT)]
Rutger Matthes 1Nils-Olaf Hübner 1
Claudia Bender 1
Ina Koban 2
Klaus-Dieter Weltmann 3
Axel Kramer 1
1 Institut für Hygiene und Umweltmedizin der Ernst-Moritz-Arndt-Universität, Greifswald, Deutschland
2 Zentrum für Zahn-, Mund- und Kieferheilkunde Greifswald, Ernst-Moritz-Arndt Universität, Greifswald, Deutschland
3 Leibniz-Institut für Plasmaforschung und Technologie e.V., Greifswald, Deutschland
Zusammenfassung
In jüngster Zeit gewinnt die Anwendbarkeit von gewebeverträglichem Plasma (Tissue Tolerable Plasma – TTP) auf der Körperoberfläche u.a. zur Wundbehandlung an Bedeutung. Hierfür kommt eine Vielzahl verschiedener Plasmaquellen in Frage. Um verlässliche Untersuchungsergebnisse beim Einsatz von Plasmaquellen zu gewährleisten, muss neben der Bestimmung der physikalischen Parameter zuvor ein anwendungsbezogenes Screening der Plasmaquellen erfolgen, um nicht nur deren Effekte auf biologische Systeme, sondern auch um eine homogene Plasmawirkung auf den zu behandelnden Oberflächen zu bestimmen.
In dieser Arbeit wird hierfür als einfache Screeningmöglichkeit die Exposition frisch beimpfter Agarplatten mit Testbakterien anhand von zwei Oberflächen-Barriere-Entladungs (surface barrier discharged – SBD)-Plasmen mit Argon und Luft als Trägergas vorgestellt.
Schlüsselwörter
Tissue Tolerable Plasma (TTP), Dielektrische Barriere-Entladung, DBE, SBD, Qualitätsscreening, Mikroorganismen-Agar-Test (MAT), Pseudomonas aeruginosa, Staphylococcus epidermidis
Einleitung
Bereits seit Längerem werden physikalische Plasmen als alternative Sterilisationsverfahren im medizinischen Bereich eingesetzt [1], [2]. Neuerdings gewinnt die Anwendung von gewebeverträglichem Plasma (Tissue Tolerable Plasma – TTP) auf der Körperoberfläche mit dem Schwerpunkt der Wundbehandlung zunehmende Bedeutung [3], [4], [5]. Zur medizinischen Nutzung stehen verschiedene Formen von TTP zur Auswahl. Eine Auswahl an Plasmaquellen für den medizinischen Bereich wird bei Kong et al. [6] sowie Weltmann et al. [7] beschrieben. Zur Wundbehandlung eignen sich sowohl Plasma-Jets als auch Barriere-Entladungs- Plasmen (BD). Oberflächen-Barriere-Entladungs-Plasmen (Surface barrier discharge – SBD) eignen sich speziell zur Behandlung von größeren Oberflächen, da das Plasma über eine Fläche verteilt erzeugt wird. Plasma-Jets bieten eine punktförmige Behandlungsfläche und können z.T. flexibel über Schlauchsysteme geleitet werden.
Die Wirkungsweise von Plasmaquellen kann stark variieren. Allein durch die verschiedenen Applikationsformen oder Modulationsmöglichkeiten (technische Parameter wie Frequenz, Spannung) einer Plasmaquelle sind vielfältige Wirkspektren möglich. Es gibt aber auch schwer ersichtliche Einflüsse auf die Wirkungsweise. Selbst Plasmaquellen mit identischen technischen Parametern können innerhalb einer Versuchsreihe eine veränderte physikochemische Wirkung auf biologische Systeme entfalten. Mögliche Ursachen sind z.B. Temperaturschwankungen, veränderte Radikalbildung oder eine ungleichmäßige Intensität der UV-Strahlung. Um verlässliche Untersuchungsergebnisse der Wirksamkeit von Plasmaquellen zu gewährleisten, wäre es hilfreich, über einen einfachen Screeningtest zu verfügen, der die Konstanz und gleichmäßige Verteilung von mit Plasma exponierten Oberflächen erfasst. Hierfür liegt es nahe, Mikroorganismen, die als Suspension gleichmäßig auf Agarplatten verteilt wurden, als biologische Testsysteme einzusetzen.
Zur Testung der Antibiofilmaktivität lässt man Mikroorganismen an Oberflächen adhärieren, damit sie dort unter geeigneten Bedingungen einen Biofilm entwickeln. Nach der Plasmaeinwirkung auf den Biofilm werden die Mikroorganismen von der Oberfläche entfernt und für die weitere Untersuchung in Suspension gebracht [8]. Die Konstanz und Gleichmäßigkeit der Plasmaeinwirkung kann hierbei allerdings nicht direkt erkannt werden. Ebenso verhält es sich bei der Einwirkung auf inhomogene Oberflächen wie z.B. Wundgewebe, bei denen unregelmäßig ausgeprägte Effekte auf die Struktur der Oberfläche zurückgeführt werden könnten.
In der vorliegenden Arbeit wurde die Eignung des Mikroorganismen-Agar-Tests (MAT) als Screening-Methode zur Prüfung der homogenen Wirksamkeit für Plasmaquellen mit flächigem Plasmafeld anhand von zwei Barriere-Entladungs-Quellen überprüft.
Methode
Erregersuspension
Für die Versuche wurden die biofilmbildenden Stämme Pseudomonas aeruginosa SG81 und Staphylococcus epidermidis RP 62A eingesetzt. Pseudomonas aeruginosa SG81 (P. aeruginosa) wurde aus einem technischen Wassersystem isoliert und ist gut charakterisiert [9]. Staphylococcus epidermidis RP 62A (S. epidermidis) wird von vielen Arbeitsgruppen als biofilmbildender Referenzstamm verwendet [10], [11], [12], [13].
Zur Herstellung der ersten Subkultur wurde eine Glasperle mit dem Erreger unter aseptischen Bedingungen aus einem Kryo-Röhrchen entnommen und auf einer Blutagar-Platte (Columbia Agar + 5% Schafsblut, bioMérieux, Nürtingen, Deutschland) ausgerollt. Die Platte wurde 24 h bei 37 °C bebrütet. Davon wurden Subkulturen auf Blutagar erstellt und für weitere 24 h bei 37 °C inkubiert. Nach anschließendem Abschwemmen und 3-maligem Waschen mit gepufferter Kochsalzlösung (PBS) mittels Zentrifugation bei 2500 U/min für 15 min wurde der Überstand dekantiert und in je 10 ml PBS resuspendiert. Mittels Verdünnungsreihe wurde die Endkonzentration der Erreger auf 104 Koloniebildende Einheiten (KbE)/ml eingestellt.
Versuchsaufbau
Es wurden Petrischalen mit einem Durchmesser von 55 mm (TPP, Trasadingen, Schweiz), und 96 mm (Sarstedt, Nümbrecht, Deutschland) mit CASO-Agar (Roth, Karlsruhe, Germany) vorbereitet. Abschließend wurden die gewaschenen Bakteriensuspensionen mit einem sterilen Wattetupfer mit einer Endkonzentration von 105 KbE/ml auf der Agaroberfläche ausgestrichen. Um gleichmäßig trockene Platten für die Testung des Plasmas zu erhalten, wurde eine Trocknungszeit von 30 min eingehalten. Direkt im Anschluss erfolgte die Plasmaapplikation. Anschließend wurden die Platten für 24 h (P. aeruginosa) bzw. 48 h (S. epidermidis) bei 37 °C bebrütet.
Plasmabehandlung
Es wurden zwei verschiedene SBD geprüft. Plasmaquelle A ist durch folgende Parameter charakterisiert: USS = 4 kV, 30 kHz, gepulst mit 250 ms An-Zeit, 750 ms Aus-Zeit, Gasfluss 5 Standardliter/min (slm) bei Argon. Plasmaquelle B hat folgende Parameter: USS = 3 kV, 40 kHz, gepulst mit 250 ms An-Zeit, 750 ms Aus-Zeit, Gasfluss 0,5 slm bei Argon (beide Quellen sind vom Leibniz Institute für Plasmaforschung und Technologie e.V. Greifswald entwickelt worden).
Die Platten wurden 30 s, 60 s und 120 s mit Plasmaquelle A und 60 s bis 6 min mit Plasmaquelle B behandelt. Der Abstand zwischen den Elektroden und der Agaroberfläche betrug 2 mm. Um bei der Behandlung mit Argon-Plasma Einflüsse von der Umgebung zu verhindern, wurde der zu behandelnde Bereich abgeschirmt und der Raum zwischen der Elektrode und der Agarfläche 1 min lang mit Argon „gespült“.
Ergebnisse
Bei mit Argon-Plasma behandelten Agarplatten (Gasfluss 5 slm) der Plasmaquelle A erfolgte die Plasmaeinwirkung im Zentrum auf einer Fläche von ca. 12 cm2 (Abbildung 1 [Abb. 1] und Abbildung 2 [Abb. 2]). Es trat eine deutliche Wachstumshemmung mit fortschreitender Behandlungsdauer auf. Im Zentrum der behandelten Fläche blieb die Fähigkeit zur Bildung von Kolonien von P. aeruginosa (Abbildung 1 [Abb. 1]) und S. epidermidis (Abbildung 2 [Abb. 2]) bestehen.
Abbildung 1: Plasmaquelle A, Argon-Plasma, Behandlungszeit von links nach rechts 30 s, 60 s und 120 s mit Pseudomonas aeruginosa SG81 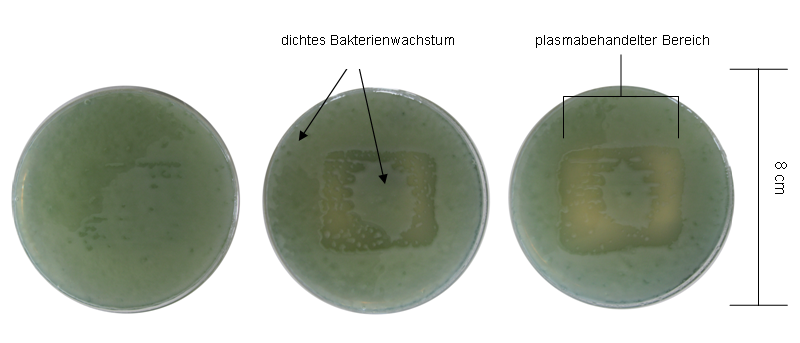
Abbildung 2: Plasmaquelle A, Argon-Plasma, Behandlungszeit von links nach rechts 30 s, 60 s und 120 s mit Staphylococcus epidermidis RP62A 
Mit Luft -Plasma behandelte Agarplatten (ohne Gasfluss) der Plasmaquelle A sind in Abbildung 3 [Abb. 3] und Abbildung 4 [Abb. 4] gezeigt. Hierbei ist eine deutliche Inaktivierung von P. aeruginosa (Abbildung 3 [Abb. 3]) und S. epidermidis (Abbildung 4 [Abb. 4]) bereits nach 30 s Plasmabehandlung vorhanden. Nach 30 s Behandlungszeit blieben v.a. im rechten oberen Bereich noch wachstumsfähige Erreger sichtbar. Der Rand auf der rechten Seite war deutlich ungleichmäßiger abgeschlossen.
Abbildung 3: Plasmaquelle A, Luft-Plasma, Behandlungszeit von links nach rechts 30 s, 60 s und 120 s mit Pseudomonas aeruginosa SG81 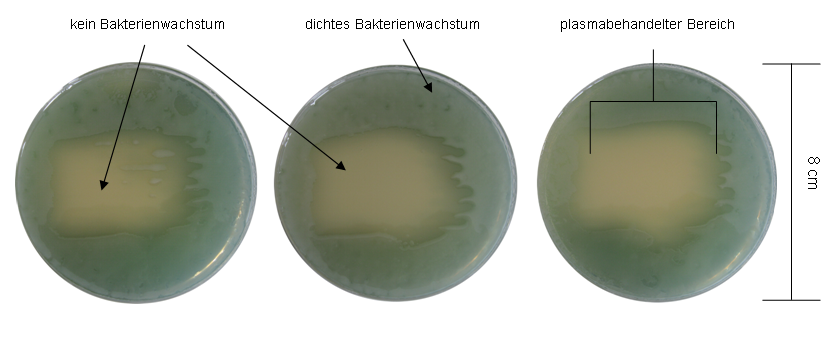
Abbildung 4: Plasmaquelle A, Luft-Plasma, Behandlungszeit von links nach rechts 30 s, 60 s und 120 s mit Staphylococcus epidermidis RP62A 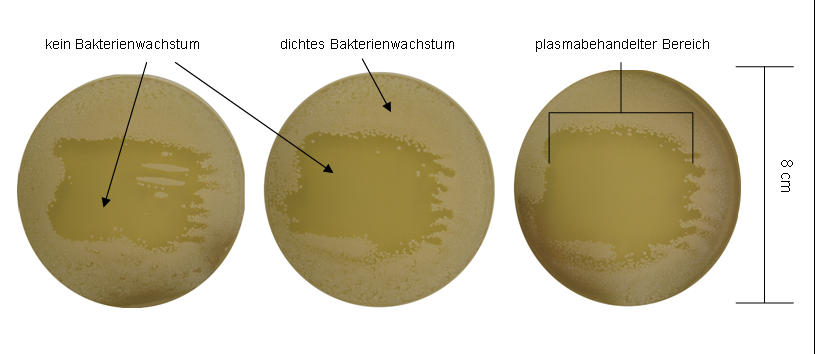
In Abbildung 5 [Abb. 5] sind mit Argon-Plasma (Gasfluss 0,5 slm) behandelte Agarplatten mit S. epidermidis und P. aeruginosa der Plasmaquelle B gezeigt. Im Zentrum erfolgte auf einer runden Fläche von ca. 10 cm2 die Plasmaeinwirkung. Beide Platten der Abbildung 5 [Abb. 5] waren vollständig bewachsen.
Abbildung 5: Plasmaquelle B, Argon-Plasma, Behandlungszeit 6 min mit Pseudomonas aeruginosa SG81 (links, dichtes Bakterienwachstum) und Staphylococcus epidermidis RP62A (rechts, dichtes Bakterienwachstum) 
Mit Luft-Plasma (ohne Gasfluss) der Plasmaquelle B behandelte Agarplatten mit S. epidermidis und P. aeruginosa sind nach identischer Plasmabehandlung in Abbildung 6 [Abb. 6] und Abbildung 7 [Abb. 7] gezeigt. Auf der linken Seite war ein deutlicherer Bewuchs erkennbar, während rechts nach gleicher Behandlungszeit nur vereinzelte Kolonien übrig blieben.
Abbildung 6: Plasmaquelle B, Luft-Plasma, Behandlungszeit 1 min mit Pseudomonas aeruginosa SG81 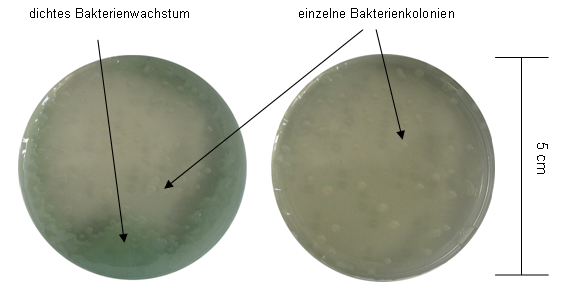
Abbildung 7: Plasmaquelle B, Luft-Plasma, Behandlungszeit 2 min mit Pseudomonas aeruginosa SG81 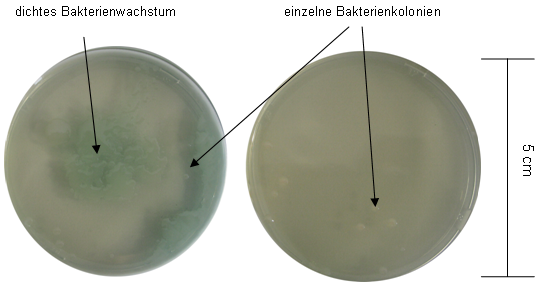
Diskussion
Die Behandlung von auf Agarnährboden ausgestrichenen Bakterien ist ein einfacher Test. Er wird oft zum Nachweis der antimikrobiellen Wirksamkeit von Plasmaquellen verwendet, z. B. bei Pompl et al. [14], Laroussi et al. [15], Shimizu et al. [16] und Morfill et al. [17]. Der MAT ist aber zugleich geeignet, um Aussagen über die Stabilität und Homogenität der biologischen Plasmawirkung zu treffen.
In Abbildung 1 [Abb. 1] und Abbildung 2 [Abb. 2] sind das Wachstum bzw. die Inaktivierung von P. aeruginosa und S. epidermidis nach zeitabhängiger Argon-Plasmabehandlung der Plasmaquelle A gezeigt. Innerhalb des behandelten Bereichs ist eine Inaktivierungszone erkennbar, die mit verlängerter Behandlungszeit deutlicher wird. Jedoch bleibt unabhängig von der Einwirkungszeit im Zentrum eine vitale Zone mit bakteriellem Wachstum erhalten. Im Gegensatz hierzu ist dieses Phänomen in Abbildung 3 [Abb. 3] und Abbildung 4 [Abb. 4] nach der Behandlung mit der gleichen Plasmaquelle nicht vorhanden. Hier bleibt nur der rechte Rand des behandelten Bereichs fransig. Der Unterschied beider Behandlungen liegt im Trägergas Argon bzw. Luft für das Plasma. Bei der Argon-Plasmabehandlung wurde ein möglicher Einfluss der Umgebungsluft verhindert, so dass sich daraus schließen lässt, dass die Verteilung des „after glow“ unter der Fläche (Abbildung 1 [Abb. 1] und Abbildung 2 [Abb. 2]) nicht gleichmäßig stattfand. Zusätzlich ist im Vergleich der Erreger eine geringere Sensitivität gegen Argon-Plasma von S. epidermidis mit stärkerem Wachstum gegenüber P. aeruginosa feststellbar. Abbildung 5 [Abb. 5] zeigt P. aeruginosa und S. epidermidis nach Plasmabehandlung mit einer Dauer von 6 min mit Quelle B. Es fand keine Inaktivierung der Erreger statt, der Agar wurde vollständig bewachsen. Die Ergebnisse der Plasmaquelle A, die einen antimikrobiellen Effekt bereits nach 30 s Argon-Plasma zeigt, machen deutlich, dass die biologische Wirkung einer Plasma-Art (hier SBD) stark von der Bauweise und dem Leistungseintrag/ Behandlungsfläche der Quelle abhängt. Möglicherweise gibt es einen Schwellenwert, im Leistungseintrag, ab dem Argon-Plasma erst einen antimikrobiellen Effekt aufweist. Interessanterweise macht sich der Unterschied bei Luft-Plasma so nicht bemerkbar (Abbildung 3 [Abb. 3] und Abbildung 4 [Abb. 4]).
Bei Abbildung 6 [Abb. 6] und Abbildung 7 [Abb. 7] sind deutliche Effekte bei P. aeruginosa erkennbar. Die bakterielle Inaktivierung gleich behandelter Platten, bei Abbildung 6 [Abb. 6] und Abbildung 7 [Abb. 7], unterscheidet sich jedoch deutlich. Die Plasmaquelle B ist mehrmals baugleich vorhanden, so dass die Behandlung parallel verlaufen konnte. Die Ergebnisse mit S. epidermidis, nach den Behandlungen mit Luft-Plasma, wurden nicht dargestellt, da kein Wachstum nach 1 min mehr erfolgte. Es ist denkbar, das S. epidermidis empfindlicher als P. aeruginosa auf Luft-Plasma reagiert.
Die Untersuchung ergab, dass bereits geringe Unterschiede im Aufbau der Plasmaapplikation und vermutlich auch zwischen Geräten gleicher Bauweise eine veränderte Wirkung auf biologische Systeme zur Folge haben können.
Auf Grund der möglichen Abweichungen in der antibakteriellen Wirksamkeit von gleichen Fabrikaten wird in unserem Labor ein derartiges Screening zukünftig routinemäßig vor der Erprobung spezieller medizinischer Applikationen durchgeführt.
Ein solches Screening ist bei allen Plasmaanwendungen hilfreich, die über eine Veranschaulichung der antibakteriellen Effektivität einer Quelle hinausgehen. Plasmabehandlungen von Lösungen, Biofilmen und Zellkulturen oder Oberflächenbehandlungen sind Beispiele hierfür. Häufig wird eine optische Begutachtung der Lichtentwicklung des erzeugten Plasmas als ausreichend angesehen. Jedoch können nicht nur externe Einflussfaktoren (z.B. Raumtemperatur, Luftfeuchtigkeit, Sauerstoffgehalt) Schwankungen der Plasmawirkung hervorrufen, sondern auch technisch verborgene Faktoren (z.B. die Verteilung des „after-glow“).
Für den verlässlichen Einsatz des MATs wird vorausgesetzt, dass die Agarplatte gleichmäßig mit dem Erreger bestrichen wird, damit es zu keinen erheblichen Schwankungen der Erregerdichte auf der zu behandelnden Fläche kommt. Die Oberfläche des Agars muss eben und horizontal sein, um einen gleichmäßigen Abstand zur Elektrode zu gewährleisten.
Konklusion
Um Fehlinterpretationen von Versuchergebnissen zu vermeiden, werden Vortests zur Überprüfung der Plasmaquelle empfohlen, besonders wenn diese sich noch im Entwicklungsstadium befindet. Der MAT ist ein hilfreiches Werkzeug, um die Qualität der Wirkung einer flächigen Plasmaquelle kenntlich zu machen. Er lässt sich als Screeningmethode mit Bewertung nach frühestens 24 h zur Beurteilung der Konstanz und Homogenität der antimikrobiellen Plasmawirkung neuer Plasmaquellen nutzen.
Danksagung
Die Arbeit wurde innerhalb des 2008 vom Bundesministerium für Bildung und Forschung (BMBF) bewilligten interdisziplinären Projekts „CampusPlasmaMed“ innerhalb des Leitprojekts „PlasmaBiozid“ erstellt. Die Autoren danken dem BMBF für die Förderung (BMBF, Förderkennzeichen 13N9779).
Literatur
[1] Höller C, Martiny H, Christiansen B, Rüden H, Gundermann KO. The efficacy of low temperature plasma (LTP) sterilization, a new sterilization technique. Zentralbl Hyg Umweltmed. 1993;194(4):380-91.[2] Chau TT, Kao KC, Blank G, Madrid F. Microwave plasmas for low-temperature dry sterilization. Biomaterials. 1996;17(13):1273-7. DOI: 10.1016/S0142-9612(96)80003-2
[3] Kramer A, Lindequist U, Weltmann KD, Wilke C, von Woedtke T. Plasma Medicine – its perspective for wound therapy. GMS Krankenhaushyg Interdiszip. 2008;3(1):Doc16. Available from: http://www.egms.de/en/journals/dgkh/2008-3/dgkh000114.shtml
[4] Weltmann KD, von Woedtke T, Brandenburg R, Ehlbeck J. Biomedical applications of atmospheric pressure plasma. II Central European Symposium on Plasma Chemistry 2008. Chem Listy. 2008;102:s1450-s1451. Available from: http://www.chemicke-listy.cz/docs/full/2008_16_s1450-s1451.pdf
[5] Lloyd G, Friedman G, Jafri S, Schultz G, Fridman A, Harding K. Gas Plasma: Medical Uses and Developments in Wound Care. Plasma Process Polym. 2010;7:194-211. DOI: 10.1002/ppap.200900097
[6] Kong MG, Kroesen G, Morfill G, Nosenko T, Shimizu T, van Dijk J, Zimmermann JL. Plasma medicine: an introductory review. New J Phys. 2009;11:115012. DOI: 10.1088/1367-2630/11/11/115012
[7] Weltmann KD, Kindel E, von Woedtke T, Hähnel M, Stieber M, Brandenburg R. Atmospheric-pressure plasma sources: Prospective tools for plasma medicine. Pure Appl Chem. 2010;82(6):1223-37. DOI: 10.1351/PAC-CON-09-10-35
[8] Koban I, et al. Killing and removal of dental biofilms from titanium implant surfaces. In: BMT 2010. (BMT 2010 Reguläre Beiträge). Rostock-Warnemünde, Germany; 2010.
[9] Grobe S, Wingender J, Trüper HG. Characterization of mucoid Pseudomonas aeruginosa strains isolated from technical water systems. J Appl Bacteriol. 1995;79(1):94-102.
[10] Christensen GD, Barker LP, Mawhinney TP, Baddour LM, Simpson WA. Identification of an antigenic marker of slime production for Staphylococcus epidermidis. Infect Immun. 1990;58(9):2906-11.
[11] Anglen J, Apostoles PS, Christensen G, Gainor B, Lane J. Removal of surface bacteria by irrigation. J Orthop Res. 1996;14(2):251-4. DOI: 10.1002/jor.1100140213
[12] Sadovskaya I, Vinogradov E, Flahaut S, Kogan G, Jabbouri S. Extracellular carbohydrate-containing polymers of a model biofilm-producing strain, Staphylococcus epidermidis RP62A. Infect Immun. 2005;73(5):3007-17. DOI: 10.1128/IAI.73.5.3007-3017.2005
[13] König DP, Perdreau-Remington F, Rütt J, Stossberger P, Hilgers RD, Plum G. Slime production of Staphylococcus epidermidis: increased bacterial adherence and accumulation onto pure titanium. Acta Orthop Scand. 1998;69(5):523-6. DOI: 10.3109/17453679808997791
[14] Pompl R, et al. The effect of low-temperature plasma on bacteria as observed by repeated AFM imaging. New J Phys. 2009;11:115023. DOI: 10.1088/1367-2630/11/11/115023
[15] Laroussi M, Tendero C, Lu X, Alla S, Hynes WL. Inactivation of Bacteria by the Plasma Pencil. Plasma Process Polym.2006;3(6-7):470-3. DOI: 10.1002/ppap.200600005
[16] Shimizu T, Steffes B, Pompl R, Jamitzky F, Bunk W, Ramrath K, et al. Characterization of Microwave Plasma Torch for Decontamination. Plasma Process Polym. 2008;5(6):577-82. DOI: 10.1002/ppap.200800021
[17] Morfill GE, Shimizu T, Steffes B, Schmidt HU. Nosocomial infections-a new approach towards preventive medicine using plasmas. New J Phys. 2009;11:115019. DOI: 10.1088/1367-2630/11/11/115019




