[Influencing of the penetration of Pseudomonas aeruginosa into a 3-D epidermis model and the inactivation with tissue tolerable plasma]
Rutger Matthes 1Claudia Bender 1
Nils-Olaf Hübner 1
Gerald Müller 1
Katharina Kohl 1
Jaqueline Mentz 1
Ina Koban 2
Eckhard Kindel 3
Thomas Kocher 2
Klaus-Dieter Weltmann 3
Jürgen Lademann 4
Axel Kramer 1
1 Institut für Hygiene und Umweltmedizin, Ernst-Moritz-Arndt Universität, Greifswald, Deutschland
2 Zentrum für Zahn-, Mund- und Kieferheilkunde Greifswald, Ernst-Moritz-Arndt Universität, Greifswald, Deutschland
3 Leibniz-Institut für Plasmaforschung und Technologie e.V., Greifswald, Deutschland
4 Zentrum für Angewandte Hautphysiologie an der Klinik für Dermatologie, Venerologie und Allergologie, Charité - Universitätsmedizin Berlin Campus Charité, Deutschland
Abstract
Aim: The biofilm formation plays a crucial role in the pathogenesis of many acute and subacute microbial infections as well as of chronic wounds. For the stimulation of wound healing tissue tolerable plasma (TTP) is an alternative to antiseptic or chemotherapeutic therapies.
The mechanical influence of argon plasma on the penetration of bacteria into the tissue related to the antimicrobial effect of the plasma is unknown. Hence the effects of argon plasma versus argon gas were examined for bacterial reduction as well as for the penetration depth of P. aeruginosa in a 3-D human epidermis model, the so-called combi-model.
Method: 3-D NHEK cell cultures were inoculated with P. aeruginosa SG81 and treated after 20 min incubation with TTP. The distribution and penetration depth of the bacteria in the cell culture were compared by confocal laser scan microscope (CLSM) between control and TTP effect.
Result: The penetration of bacteria into the epidermis tissue and a significant reduction of the bacteria could be proven by means of TTP. Therefore justified chances result for treatment of wounds with TTP.
Keywords
low temperature plasma, HF-Plasma Jet, tissue tolerable plasma, Pseudomonas aeruginosa, infection of epidermis equivalents, antiseptic plasma effect
Einleitung
Die Biofilmbildung spielt eine entscheidende Rolle in der Pathogenese vieler akuter und chronischer mikrobieller Infektionen einschließlich chronischer Wunden [1]. Bakterielle Biofilme sind bis zu 1000-fach resistenter gegenüber Therapien mit Antibiotika und Antiseptika als planktonisch lebende Bakterien [2], [3], [4].
Niedertemperaturplasma wirkt dosisabhängig mikrobiozid [5], [6], [7] und ist im Bereich gewebeverträglicher Temperaturen auch auf der Körperoberfläche anwendbar [8], [9], [10]. Im Unterschied zur chemischen Antiseptik kann dem Wundgewebe durch die Anwendung von Plasma zugleich Energie zugeführt werden, was zur Förderung des Heilungsprozesses beitragen dürfte. Deshalb wird die Möglichkeit der medizinischen Plasmaanwendung weltweit in hierfür spezialisierten Zentren untersucht. Gewebeverträgliches Plasma (tissue tolerable plasma – TTP) kann eine Alternative zur antiseptischen Behandlung biofilmassoziierter Wundinfektionen darstellen
Beim Einsatz des HF-Plasmajets kINPen09 (INP, Greifswald) wird das generierte Plasma in einem Gasstrom getragen. Dabei erzeugt der Gasdruck einen mechanischen Effekt auf die zu behandelnde Oberfläche. Aus diesem Grund ist es von Interesse, den Effekt des alleinigen Gasdrucks mit dem des Plasmas auf die Verteilung der Bakterien in den oberen Gewebeschichten und die antimikrobielle Wirksamkeit zu untersuchen. Der Nebeneffekt des Gasdrucks von TTP wurde bisher nicht berücksichtigt, könnte aber einen Einfluss auf den Behandlungserfolg haben. Das Ziel dieser Arbeit war es daher, den Einfluss der Plasmabehandlung sowohl auf die Verteilung als auch auf die Reduktion von Bakterien im 3-D-Epidermismodell zu untersuchen.
Material und Methoden
Für die Versuche wurde P. aeruginosa SG81 eingesetzt. Dieser Stamm wurde vom Biofilm Center Duisburg-Essen, Deutschland, aus einem Biofilm in einem technischen Wassersystem isoliert und ist als Biofilmbildner gut charakterisiert [11], [12]. Nach Anzucht auf Blutagar wurden Subkulturen wiederum auf Blutagar erstellt und für 24 h bei 37°C inkubiert. Nach anschließendem Abschwemmen und 3-maligem Waschen wurde bei 2500 U/min für 15 min zentrifugiert, der Überstand dekantiert und in je 5 ml gepufferter Kochsalzlösung (PBS) resuspendiert. Dem zur Färbung im Epidermismodell vorgesehenen Bakterienpellet wurden nach dem letzten Zentrifugieren 500 µl einer Lösung von 100 µg Acridin Orange/mL (AppliChem-BioChemica, Darmstadt, Deutschland) zugegeben, resuspendiert und 20 min inkubiert. Die gefärbte Bakteriensuspension enthielt ca. 1x109 KbE/ml und wurde 2x mit PBS gewaschen, um den Fluoreszenzfarbstoff zu eliminieren und danach auf die Startkonzentration von 1x107 KbE/ml verdünnt. Für die Bestimmung der KbE (separater Ansatz) wurden ungefärbte Erreger verwendet. Die Startkonzentration lag ebenfalls bei 1x107 KbE/ml.
Die Anzucht von normalen humanen epidermalen Zellen (NHEK) erfolgte nach mehrfacher Passage auf kommerziellen Polycarbonat-Inserts (Millicell®, Millipore Corp., Billerica, Massachusetts, USA) unter Verwendung serum- und antibiotikafreier Medien unter aseptischen Kautelen [13]. Durch Stratifizierung und Keratinisierung bildeten sich dreidimensionale Strukturen aus, die im Aufbau der menschlichen Epidermis entsprechen. Die Qualitäts- und Vitalitätsprüfung dieser Epidermismodelle (EM) erfolgte mittels MTT-Test [14] und durch Messung des Transepidermalen Elektrischen Widerstands (TER) unter Verwendung eines Volt-Ohmmeters mit Spezialelektrode (EVOMX und STX2-Elektrode, World Precision Instruments, Berlin). Die Epidermismodelle kamen am Tag 18 nach Airlift zum Einsatz.
25 µl der Fertigsuspension der gefärbten Bakterien wurden auf je ein Epidermismodell gegeben und anschließend bei 37°C für 20 min inkubiert. Je 8 Epidermismodelle wurden mit Argon-Plasma bzw. mit Argon behandelt. Als Kontrolle wurden 6 Epidermismodelle entsprechend der Gesamtbehandlungszeit, der Plasma- und Argonbehandlung, mitgeführt. Jeweils 6 der Epidermismodelle der Teilversuche wurden mikrobiologisch über die KbE und je 2 wurden mikroskopisch ausgewertet.
Als Plasmaquelle wurde ein HF-Plasmajet (Frequenz 1.82 MHz, Eingangsleistung 3 W) (kINPen 09, INP Greifswald), unter Verwendung von Argon als Trägergas [15], [16] verwendet. Das im Jet generierte Plasma (räumliches after-glow Plasma, effluent) wird während der Behandlung bei einer Argon-Gasflussrate von 5 slm (Standardliter/min) auf die zu behandelnde Oberfläche gerichtet, wobei die Temperatur an der Plasmaspitze 42°C betrug (nach Temperatur-Kalibrierkurve, INP Greifswald). Bei dieser Temperatur wird auf der Oberfläche eine mittlere Wärmeleistung von etwa 150 mW generiert.
Zur Plasmaanwendung wurde der Plasmajet in einen computergesteuerten xyz-Tisch eingespannt und die zu behandelnden Epidermismodelle (EM) in der Mikrotiterplatte unter dem Jet positioniert (Abbildung 1 [Abb. 1]). Der Abstand zu den Proben betrug 7 mm. Die gesamte Fläche der Epidermismodelle wurde mäanderförmig mit der Fahrgeschwindigkeit von 10 mm/s behandelt. Die Gesamtbehandlungsdauer je Probe betrug jeweils 1 min.
Abbildung 1: Vorrichtung zur Plasmabehandlung der Zell-Inserts
Die Bestimmung der KbE erfolgte nach Präparation der Polycarbonatmembran mitsamt dem darauf befindlichen Gewebe aus dem Insert-Ring. Die Membran wurde mit dem anhaftenden Gewebe in ein Reagenzröhrchen mit 5 ml physiologischer Kochsalzlösung überführt und anschließend mechanisch mit einem Glasstab 5 min homogenisiert. Die gewonnene Suspension wurde 10 min bei 130 W mit Ultraschall behandelt, 15 min bei 2500 U/min zentrifugiert und nach der spread-plate-Methode [17] bestimmt.
Die mikroskopische Auswertung erfolgte mit einem Zeiss CLSM510 Exciter, Carl Zeiss Jena, Deutschland.
Ergebnisse
Die Reduktion der Erreger betrug im Mittel 1,7 log10 (KI ±0,16, 95%-Kl) im Vergleich zur Kontrolle. Im Vergleich zum Argon betrug die Reduktion 1,2 log10 (p<0,01, signifikant nach Wilcoxon-Mann-Whitney-Test) und beschreibt somit die reine Plasmawirkung (Abbildung 2 [Abb. 2]). Die Reduktion des Argon-Gasstroms im Vergleich zur Kontrolle ist dagegen nicht signifikant.
Abbildung 2: Wirksamkeit von TTP im Vergleich zur Behandlung mit Argon und Kontrolle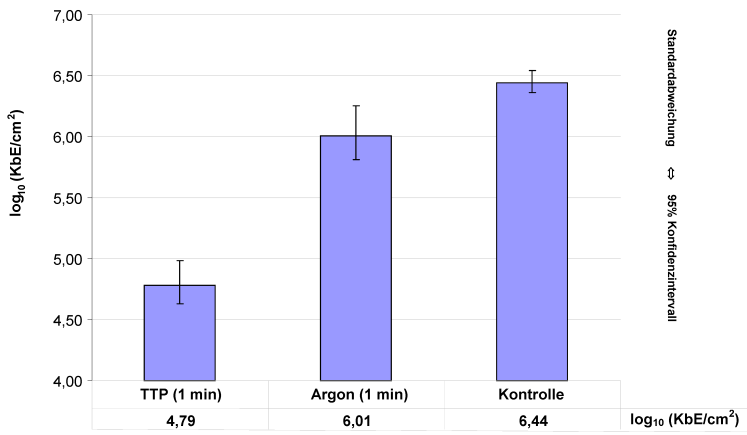
Anhand der CLSM-Untersuchung konnte ein Eindringen der Bakterien in das Gewebe nach TTP-Behandlung, Begasung mit reinem Argon und ebenso bei der unbehandelten Kontrolle beobachtet werden. Nach der TTP-Anwendung zeigte sich eine Eindringtiefe der Bakterien von ca. 16 µm (Abbildung 3 [Abb. 3]) und nach Argon von ca. 32 µm (Abbildung 4 [Abb. 4]) im Vergleich zur Kontrolle mit ca. 14 µm Eindringtiefe (Abbildung 5 [Abb. 5]).
Abbildung 3: Verteilung von P. aeruginosa SG 81in den Keratinozytenschichten im Epidermismodell in unterschiedlichen Schichttiefen nach TTP-Behandlung für 1 min (Fluoreszenzfarbstoff Acridin Orange) 
Abbildung 4: Verteilung von P. aeruginosa SG 81 in den Keratinozytenschichten im Epidermismodell in unterschiedlichen Schichttiefen nach Argon-Behandlung für 1 min (Fluoreszenzfarbstoff Acridin Orange) 
Abbildung 5: Verteilung von P. aeruginosa SG 81 in den Keratinozytenschichten im Epidermismodell in unterschiedlichen Schichttiefen in der Kontrolle (Fluoreszenzfarbstoff Acridin Orange) 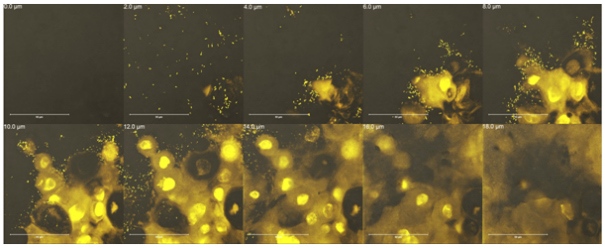
In Abbildung 6 [Abb. 6] ist zur Veranschaulichung ein dreidimensionales Bild der Kontrolle des Epidermisäquivalents wiedergegeben.
Abbildung 6: Darstellung der Kontrolle in 3-D, Fluoreszenzfarbstoff Acridin Orange, Überblick über die Verteilung von P. aeruginosa SG81 auf und zwischen den Keratinozyten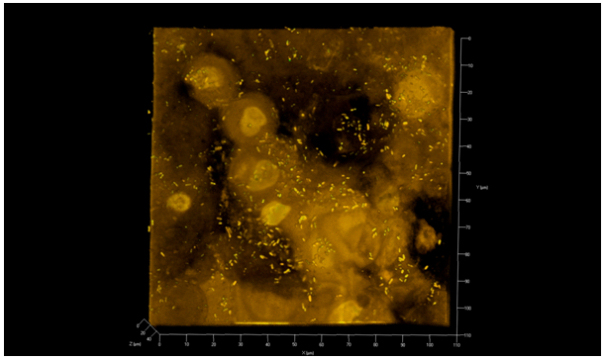
Diskussion
Biofilme erschweren die Behandlung mikrobieller Infektionen. Das gilt insbesondere, wenn abiotische Fremdkörper in der Wunde vorhanden sind und eine dem Immunsystem schwer zugängliche Grundlage zur Biofilmentstehung bilden [1]. Die Therapie mikrobieller Biofilme mit antiseptischen Maßnahmen stößt bei der Behandlung von Biofilmen aufgrund der erhöhten Resistenz der Erreger an ihre Grenzen. Vor diesem Hintergrund kommt der physikalischen Behandlung von Biofilmen eine besondere Bedeutung zu. TTP ist eine potentielle physikalische Alternative zur chemischen Antiseptik, da im Epidermismodell durch TTP-Applikation eine Reduktionsrate von 1,7 (log10) und auf Polystyrol und Silicon bei gleichen Plasma-Einstellungen eine Reduktion des P. aeruginosa SG 81 von 3 log10 erreicht wurde [7]. In den letzten Jahren sind an mehreren Zentren Plasmaquellen zur Wundbehandlung entwickelt und getestet worden [18], [19], [20], [21]. Der Vorteil physikalischer Verfahren liegt in ihrer Standardisierbarkeit und dem Fehlen des Eintrags des Antiseptikums mit möglichen zytotoxischen Effekten in der Wunde.
In unseren Versuchen zeigte sich, dass die durch TTP erreichte Reduktion mit 1,2 log10 statistisch signifikant war und bestätigt, dass eine antibakterielle Wirkung in der humanen Epidermis mittels TTP erreichbar ist.
In der vorliegenden Untersuchung wurde das Eindringen von P. aeruginosa SG 81 in Epidermismodelle untersucht. In der Kontrolle fand eine Penetration der Bakterien in das Gewebe statt, was auf ihre Eigenbewegung schließen lässt. Es zeigte sich, dass bei den mit Gas behandelten Epidermismodellen die Bakterien tiefer in das Gewebe eingedrungen sind, während dieser Effekt unter Plasmaeinwirkung weniger ausgeprägt war. Da Plasma zu einer Inaktivierung und damit zu einer reduzierten Motilität der Bakterien führt, kann das der Grund dafür sein, dass die Bakterien im Vergleich zu reinem Argon-Gas weniger stark in das Gewebe penetrieren. Damit liefern die Ergebnisse einen ersten Anhaltspunkt, dass der Gasdruck von Einfluss auf die Verteilung der Erreger und für deren Inaktivierung sein kann. Zur Absicherung sind weitere Untersuchungen geplant. Zugleich sind diese Ergebnisse richtungweisend für die Entwicklung neuer Plasmaquellen.
Danksagung
Die Arbeit wurde innerhalb des 2008 vom Bundesministerium für Bildung und Forschung (BMBF) bewilligten interdisziplinären Projekts „CampusPlasmaMed“ innerhalb des Leitprojekts „PlasmaBiozid“ erstellt. Die Autoren danken dem BMBF für die Förderung (BMBF, Förderkennzeichen 13N9779).
Literatur
[1] Pozo JL, Patel R. The challenge of treating biofilm-associated bacterial infections. Clin Pharmacol Therap. 2007;82(2):204-9. DOI: 10.1038/sj.clpt.6100247[2] Fux CA, Costerton JW, Stewart PS, Stoodley P. Survival strategies of infectious biofilms. Trends Microbiol. 2005;13(1):34-40. DOI: 10.1016/j.tim.2004.11.010
[3] Lewis K. Multidrug tolerance of biofilms and persister cells. Curr Topics Microbiol Immunol. 2008;322:107-31. DOI: 10.1007/978-3-540-75418-3_6
[4] Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms. Lancet. 2001;358(9276):135-8. DOI: 10.1016/S0140-6736(01)05321-1
[5] Abramzon N, Joaquin JC, Bray J, Brelles-Marino G. Biofilm destruction by RF high-pressure cold plasma jet. Plasma Sci IEEE Transact. 2006;34(4 Pt 2):1304-9. DOI: 10.1109/TPS.2006.877515
[6] Jiang C, Tse Chen M, Gorur A, Schaudinn C, Jaramillo DE, Costerton JW, Sedghizadeh PP, Vernier PT, Gundersen MA. Nanosecond pulsed plasma dental probe. Plasma Proc Polym. 2009;6(8):479-83. DOI: 10.1002/ppap.200800133
[7] Hübner NO, Matthes R, Koban I, Müller G, Bender C, Kindel E, et al. Efficacy of chlorhexidine, polihexanide and tissue tolerable plasma (TTP) against Pseudomonas aeruginosa biofilms on polystyrene and silicone materials. Wound Repair Regen. 2009. In press.
[8] Kalghatgi SU, Fridman G, Fridman A, Friedman G, Clyne AM. Non-thermal dielectric barrier discharge plasma treatment of endothelial cells. Conf Proc IEEE Eng Med Biol Soc. 2008;2008:3578-81.
[9] Sladek REJ, Stoffels E. Deactivation of Escherichia coli by the plasma needle. J Physics D: Appl Physics. 2005;38(11):1716-21. DOI: 10.1088/0022-3727/38/11/012
[10] von Woedtke T, Kramer A, Weltmann KD. Plasma sterilization: what are the conditions to meet this claim? Plasma Proc Polym. 2008;5(6):534-9. DOI: 10.1002/ppap.200800013
[11] Grobe S, Fiedler S, Wingender J, Overath H. Wirkung von Chlor und Wasserstoffperoxid auf schleimbildende Bakterien aus wasserführenden Systemen. Vom Wasser. 1994;83:423-40.
[12] Grobe S, Wingender J, Trüper HG. Characterization of mucoid Pseudomonas aeruginosa strains isolated from technical water systems. J appl bacteriol. 1995;79(1):94-102.
[13] Poumay Y, Dupont F, Marcoux S, Leclercq-Smekens M, Herin M, Coquette A. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Arch Dermatol Res. 2004;296(5):203-11. DOI: 10.1007/s00403-004-0507-y
[14] Müller G, Koburger T, Jethon F, Kramer A. Vergleich der bakterioziden Wirksamkeit und In-vitro-Zytotoxizität von Lavasept® und Prontosan®. GMS Krankenhaushyg Interdiszip. 2007;2(2):Doc42. Available from: http://www.egms.de/static/en/journals/dgkh/2007-2/dgkh000075.shtml
[15] Foest R, Kindel E, Ohl A, Stieber M, Weltmann KD. Non-thermal atmospheric pressure discharges for surface modification. Plasma Phys Controll Fusion. 2005;47(12B):B525-36. DOI: 10.1088/0741-3335/47/12B/S38
[16] Weltmann KD, Brandenburg R, von Woedtke T, Ehlbeck J, Foest R, Stieber M, Kindel E. Antimicrobial treatment of heat sensitive products by miniaturized atmospheric pressure plasma jets (APPJs). J Phys D: Applied Phys. 2008;41(19):194008 (6pp). Available from: http://www.iop.org/EJ/abstract/0022-3727/41/19/194008
[17] Herigstad B, Hamilton M, Heersink J. How to optimize the drop plate method for enumerating bacteria. J Microbiol Meth. 2001;44(2):121-9. DOI: 10.1016/S0167-7012(00)00241-4
[18] Stoffels E, Kieft IE, Sladek RE, van dem Bedem LJ, van der Laan EP, Steinbuch M. Plasma needle for in vivo medical treatment: recent developments and perspectives. Plasma Sourc Sci Technol. 2006;15(4):S169-80. DOI: 10.1088/0963-0252/15/4/S03
[19] Watts AE, Fubini SL, Vernier-Singer M, Golkowski C, Shin S, Todhunter RJ. In vitro analysis of nonthermal plasma as a disinfecting agent. Am J Vet Res. 2006;67(12):2030-50. DOI: 10.2460/ajvr.67.12.2030
[20] Fridman G, Peddinghaus M, Balasubramanian M, Ayan H, Fridman A, Gutsol A, Brooks A. Blood coagulation and living tissue sterilization by floating-electrode dielectric barrier discharge in air. Plasma Chem Plasma Proc. 2007;26(4):425-42. DOI: 10.1007/s11090-006-9024-4
[21] Tipa RS, Stoffels E. Effects of Plasma Treatment on Wounds. In: 13th International Conference on Biomedical Engineering, IFMBE Proceedings. Springer: Berlin; 2009. p. 1385-8. DOI: 10.1007/978-3-540-92841-6_342




